(4 + 3) sikl versiyasi - (4+3) cycloaddition
A (4 + 3) sikl versiyasi[1] a cycloaddition to'rt orasidaatom b-tizim va hosil qilish uchun uch atomli b-tizim etti kishilik uzuk. Alil yoki oksialil kationlar (propenil-2-olat) odatda uch atomli b-tizimlardan foydalaniladi, a dien (kabi butadien ) to'rt atomli b-tizim rolini o'ynaydi. Bu etti a'zoli halqalarni shakllantirish uchun mavjud bo'lgan nisbatan kam sintetik usullardan birini anglatadi stereoelektiv ravishda yuqori hosilda.[2]
Kirish
Simmetriyaga ruxsat berilgan (4 + 3) tsiklodiktsiya - bu tarixiy jihatdan kirish qiyin bo'lgan etti a'zoli halqalarni shakllantirish uchun jozibali usul. Neytral dienlar va kationli allil tizimlar (ko'pincha oksialil kationlari) kelishilgan yoki bosqichma-bosqich reaksiyaga kirishib, etti a'zodan iborat halqalarni berishi mumkin. Reaktsiyada bir qator dienlar ishlatilgan, ammo tsiklopentadien va furan halqa tizimlarida bo'lgan tsiklik, elektronlarga boy dienlar bu jarayon uchun eng yaxshi 4π tizimdir. Molekulyar ichki variantlar ham samarali.[3]
(1)

So'nggi ishlanmalar enantiyoselektiv (4 + 3) tsiklli versiyalar ko'lamini va asosiy oksialil kationini (propeniliyum-2-olat) oraliq hosil qilish uchun mavjud bo'lgan sharoitlarni kengaytirishga qaratilgan.
Mexanizm va stereokimyo
Avzallik mexanizmi
Oksialil kationlari (propenilyumolat) qaytaruvchi, engil asosli yoki fotolitik sharoitda hosil bo'lishi mumkin. A, a'-dihalo ketonlarni kamaytirish simmetrik oksialil kationlarini hosil qilishning juda mashhur usuli hisoblanadi.[4] Enolatli metall hosil bo'lgandan so'ng, halogenning dissotsilanishi natijasida musbat zaryadlangan oksialil oraliq hosil bo'ladi. Ushbu elektron yetishmaydigan 2π komponenti elektronlarga boy dienlar bilan reaksiyaga kirishib sikloheptenonlarni beradi. Tsiklik dienlar mos keladigan asiklik dienlarga qaraganda yaxshiroq yurishadi, chunki reaksiya qilish uchun dien sqisqa muddatli oksialil kationi ishtirokida -cis konformatsiyasi - tsiklik dienlar ushbu reaktiv konformatsiyada qulflangan.
(2)
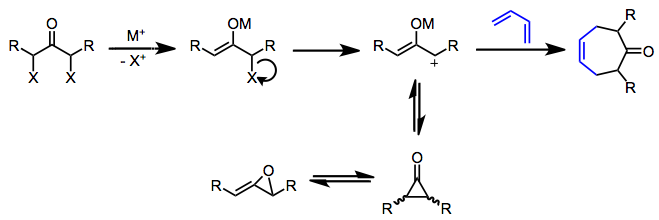
Odatda oksialillil kationini barqarorlashtirish va siklopropanonlar va allen oksidlariga izomerlanishini oldini olish uchun 1 va 3 pozitsiyalaridagi o'rinbosarlar talab qilinadi.[4] Ko'pgina hollarda oksiyalil kation oraliq moddasining izomerizatsiyasini oldini olish uchun dienning ko'pligi ishlatiladi. Metall-kislorod bog'lanishining kovalent xususiyatini oshirish (masalan, natriy o'rniga temir karbonilni kamaytiruvchi moddalarni ishlatish bilan) oksialil kationini barqarorlashtiradi va toza reaktsiyalarga olib keladi. Kuchli elektrofil allil kationlari tsiklodratsiyadan ko'ra elektrofil o'rnini bosuvchi mahsulotlarni beradi.[5]
Cycloaddition o'zi oksialil oraliq moddasining tabiati va reaktsiya sharoitlariga qarab kelishilgan yoki bosqichma-bosqich bo'lishi mumkin.[6] Reduktiv sharoitda sodir bo'lgan kontsentratsion reaktsiyalar odatda chegara orbital nazorati tufayli past regioselektivlikni namoyon qiladi; ammo, asosiy sharoitlarda bosqichma-bosqich (yoki hech bo'lmaganda asenkron) reaktsiyalar mo''tadil regioselektivlikni namoyish etadi (pi tizimlarining kamroq steril ravishda to'sqinlik qiladigan uchlari orasidagi bog'lanishning dastlabki shakllanishi bilan bog'liq).
Stereokimyo
(4 + 3) tsiklyudjetdagi stereokimyoviy nazorat, xuddi shunday qattiq emas Diels-Alder reaktsiyasi, chunki avvalgisi tez-tez bosqichma-bosqich, qutbli yo'llar orqali o'tadi. Reaksiya kelishilgan taqdirda ham, "W", "U" yoki "o'roq" shaklida bo'lishi mumkin bo'lgan oksialil komponentidagi konformatsion dinamikasi tufayli asoratlar paydo bo'lishi mumkin. Ammo, odatda, "W" shakli ustunlik qiladi. Shunday bo'lsa ham, ikkita stereokimyoviy farq qiluvchi o'tish holati mumkin: stulga o'xshash, "kengaytirilgan" TS, bu ko'prik atomi va oksialil o'rnini bosuvchi moddalar o'rtasidagi aloqaga olib keladi va qayiqqa o'xshash, "ixcham" TS trans munosabatlariga olib keladi. .
(3)
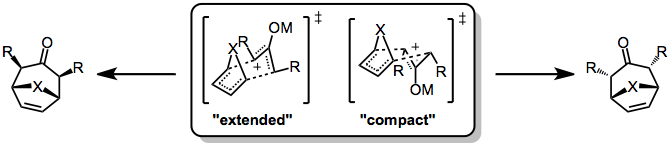
Qaysi o'tish holati maqbul ekanligi 4π va 2π reaktsiyaga kirishgan sheriklarga bog'liq. Tsiklik dienlarning reaktsiyalari kengaytirilgan TS ga nisbatan ixchamlikni afzal ko'radi (bu, ayniqsa, to'g'ri keladi) furan ). Bundan tashqari, oksialil kationining elektrofilligi kengaygan o'tish holatining qulayligi bilan bog'liq - ko'proq elektrofil kationlar (ko'proq kovalent metall-kislorodli bog'lanishlarga ega) kengaytirilgan o'tish holatini, kamroq elektrofil kationlar esa ixcham o'tish holatini afzal ko'rishadi .[7]
Qo'llash sohasi va cheklovlari
A, a'-dihalo ketonlarni kamaytirish tsiklorduktsiya uchun oksialil kationlarini hosil qilish uchun samarali usuldir. Kamaytirish vositalariga mis-bronza kiradi.,[8] temir karbonil komplekslari.,[7] va mis / rux[9] Avval aytib o'tganimizdek, mahsulotlar namoyish etilmoqda trans ko'prikli atom va oksialillil substituentlari (ixcham o'tish holatidan kelib chiqadigan) o'rtasidagi stereokimyo odatda ma'qul.
(4)
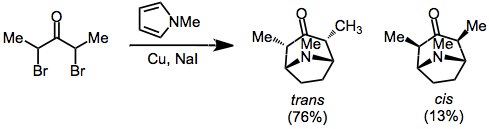
a 'holatida gidrogenlari bo'lgan a-Halo ketonlari ham asosiy sharoitlarda oksialil kationlariga aylanishi mumkin. Buning uchun odatda yuqori kutupli muhit va halofil Lyuis kislotasidan foydalanish kerak (masalan, Ag+) ba'zan kerak bo'ladi.[10]
(5)
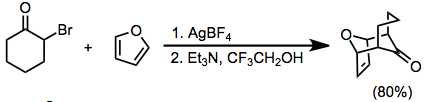
Oksialil kationlariga fotokimyoviy yo'llar, odatda siklodruktsiya sodir bo'lishidan oldin yangi kovalent bog'lanish hosil bo'lishiga olib keladi. Shunday qilib, ushbu reaksiyalar bitta ish jarayonida uchta yangi uglerod-uglerod bog'lanishini hosil bo'lishiga olib kelishi mumkin.[11]
(6)

Molekulyar (4 + 3) tsiklli versiyalar ham mumkin va ko'pincha boshqa usullar bilan kirish qiyin bo'lgan qiziqarli ko'prikli arxitekturalarga olib keladi. Masalan, quyidagi mahsulotda noyob trans-ko'prikli keton mavjud.[12]
(7)

Sintetik dasturlar
Prelog-Djerassi laktonining sintezi (4 + 3) siklizatsiya paytida o'rnatilgan stereoentrlarni keyinchalik stereokimyoviy nazorat uchun qanday ishlatilishini ko'rsatadi.[13] Furanni o'z ichiga olgan sikabolik oksidli oksabitsiklo [3.2.1] oktanli mahsulotlarini turli usullar yordamida ochish mumkin[14]
(8)

Boshqa usullar bilan taqqoslash
Besh va olti a'zoli halqalarni hosil qiladigan annulyatsiyalar bilan taqqoslaganda, etti a'zoli halqalarni hosil qiladigan annulatsiyalar nisbatan kam uchraydi. Yagona uglerod-uglerod bog'lanishini hosil qilish yo'li bilan chiziqli prekursorlarni tsikllashning klassik usullari (masalan Prins reaktsiyasi,[15] quyida ko'rsatilgan) ba'zi hollarda samarali ravishda etti a'zoli halqalarni hosil qiladi.

2 ta birlikka ega bo'lgan viniltsiklopropanlarning o'tish davri metal-katalizlangan (5 + 2) tsiklli nashrlari, shuningdek, etti a'zoli halqalarni hosil qilish uchun foydalidir.[16]

Eksperimental sharoit va protsedura
Odatda shartlar
Reduktiv sharoitda olib boriladigan tsiklli nashrlar, odatda, sotuvda mavjud bo'lgan kamaytiruvchi moddalar bilan amalga oshirilishi mumkin, ammo bir nechta kamaytiruvchi vositalar maxsus tayyorgarlikni talab qiladi. Temir karbonil komplekslarini ishlatadigan reduktiv reaksiyalar yaxshi shamollatiladigan dudbo'ronda, bepul ravishda amalga oshirilishi kerak uglerod oksidi ozod qilinishi mumkin. Baza vositachiligida tsiklloidlarning optimal sharoitlari biroz farq qiladi, garchi qutbli muhit yuqori rentabellikga ega - ftorli erituvchilar ftorlanmagan analoglariga qaraganda samaraliroq, alkoksid yoki amin asoslari boshqalarga qaraganda yaxshiroq ishlaydi.
Shuningdek qarang
Adabiyotlar
- ^ IUPAC nomenklaturasi uy sahifasi, https://www.qmul.ac.uk/sbcs/iupac/gtpoc/CoCy.html#39.
- ^ Rigbi, J. X .; Pigge, F. C. Org. Javob bering. 1997, 51, 351. doi:10.1002 / 0471264180.or051.03
- ^ Xarmata, M .; Elahmad, S .; Barns, C. L. Tetraedr Lett. 1995, 36, 1397.
- ^ a b Bingem, R. C .; Dyuar, M. J. S .; Mana, D. H. J. Am. Kimyoviy. Soc. 1975, 97, 1302.
- ^ Xenning, R .; Hoffmann, H. M. R. Tetraedr Lett. 1982, 23, 2305.
- ^ Xill, A. E.; Hoffmann, H. M. R. J. Am. Kimyoviy. Soc. 1974, 96, 4597.
- ^ a b Hoffmann, H. M. R. Angew. Kimyoviy. Int. Ed. Ingl. 1984, 23, 1.
- ^ Takaya, H .; Makino, S .; Xayakava, Y .; Noyori, R. J. Am. Kimyoviy. Soc. 1978, 100, 1765.
- ^ Giguere, R. J .; Rouson, D. I .; Hoffmann, H. M. R. Sintez 1978, 902.
- ^ Mann, J .; Uayld, P. D .; Finch, M. V. J. Chem. Soc., Kimyo. Kommunal. 1985, 1543.
- ^ G'arbiy, F. G .; Xartke-Karger, C .; Koch, D. J .; Kuehn, C. E.; Orif, A. M. J. Org. Kimyoviy. 1993, 58, 6795.
- ^ Xarmata, M .; Elomari, S .; Barns, C. L. J. Am. Kimyoviy. Soc. 1996, 118, 2860.
- ^ Oq, J. D .; Fukuyama, Y. J. Am. Kimyoviy. Soc. 1979, 101, 226.
- ^ Sato, T .; Vatanabe, M.; Noyori, R. Tetraedr Lett. 1978, 4403.
- ^ Mehta, Goverdhan; Krishnamurti, Nacharaju; Karra, Srinivas Rao (1991). "Terpenoidlardan terpenoidlarga: 5,6-, 5,7- va 5,8-birlashtirilgan bisiklik tizimlarning enantiyoselektiv qurilishi. Izodaukan sesquiterpenes va dolastan diterpenlarning umumiy sinteziga tatbiq etish". Amerika Kimyo Jamiyati jurnali. 113 (15): 5765–5775. doi:10.1021 / ja00015a034.
- ^ Vender, Pol A.; Takaxashi, Xisashi; Vitulski, Bernxard (1995). "Transition Metal Catalyzed [5 + 2] Viniltsiklopropanlar va Alkinlarning sikl nashrlari: etti a'zoli halqalarni sintezi uchun Diyel-Alder reaktsiyasining homologi". Amerika Kimyo Jamiyati jurnali. 117 (16): 4720–4721. doi:10.1021 / ja00121a036.
