Aktin yig'ilishini keltirib chiqaradigan protein - Actin assembly-inducing protein
| Aktin yig'ilishini keltirib chiqaradigan oqsil | |||||||
|---|---|---|---|---|---|---|---|
 EVH1 domeni-ActA peptid kompleksi | |||||||
| Identifikatorlar | |||||||
| Belgilar | ActA | ||||||
| NCBI geni | 2798121 | ||||||
| UniProt | P33379 | ||||||
| |||||||
The Aktin yig'ilishini keltirib chiqaradigan oqsil (ActA) a oqsil tomonidan kodlangan va ishlatilgan Listeriya monotsitogenlari o'zini sutemizuvchi hayvonlar hujayrasi orqali harakatga keltirish. ActA - membrana tarqaladigan hududni o'z ichiga olgan bakterial sirt oqsili.[1] Sutemizuvchilar hujayrasida bakteriya AktA bilan o'zaro ta'sir qiladi Arp2 / 3 kompleksi va aktin aktin kometasining dumini hosil qiluvchi bakteriyalar yuzasida aktin polimerizatsiyasini keltirib chiqaradigan monomerlar. ActA kodlovchi gen nomlangan aktA yoki prtB.[2]
Kirish
Bo'lishi bilanoq L. monotsitogenlar bakteriyalar odam tomonidan yutiladi, ular ichkariga kiradi ichak epiteliyasi hujayralar va ularning ichki vakuolasidan tezda qochishga harakat qiling.[3][4] Sitozolda ular AktA oqsili yordamida o'z yuzalarida aktinni polimerizatsiya qila boshlaydilar. Ko'rsatilganidek, ActA nafaqat zarur, balki boshqa bakterial omillar mavjud bo'lmaganda bakteriyalarning harakatchanligini keltirib chiqarish uchun ham etarli.[5]
Kashfiyot
ActA tahlil qilish orqali topildi lesitinaza - salbiy Tn917 lak Listeria mutantlari fenotip tufayli hujayradan hujayraga tarqala olmagan. Ushbu mutant bakteriyalar hanuzgacha fagosomalardan yovvoyi bakteriyalar singari samarali ravishda qochib, yuqtirilgan hujayralar ichida ko'paygan, ammo ular yovvoyi bakteriyalar singari aktin bilan o'ralmagan. Keyinchalik tahlil shuni ko'rsatdiki, Tn917 lak ichiga kiritilgan edi aktA, operonning ikkinchi geni. Ushbu operonning uchinchi geni, plcB, kodini kodlaydi L. monotsitogenlar lesitinaza. Yo'qligini aniqlash uchun aktA o'zi, plcB yoki boshqa birgalikda transkripsiyalangan quyi oqim mintaqalari aktin yig'ilishida ishtirok etsa, tegishli genlarda mutatsiyalar hosil bo'lgan. Dan tashqari barcha mutantlar aktA mutantlar F-aktin bilan birikish va hujayra hujayralarining tarqalishi bilan bog'liq bo'lgan yovvoyi tipga o'xshash edi. Bilan to'ldirish aktA ichida qayta tiklangan yovvoyi turdagi fenotip aktA mutantlar.[1]
Funktsiya

ActA - bu taqlid vazifasini bajaradigan oqsil Wiskott-Aldrich sindromi oqsili (WASP), xujayrali hujayralarda mavjud bo'lgan yadro hosil qiluvchi omil (NPF). Sutemizuvchi hujayralardagi NPFlar yollanib, allaqachon mavjud bo'lganlar bilan bog'lanadi aktin bilan bog'liq bo'lgan oqsil 2 va 3 kompleksi (Arp2 / 3 kompleksi) va Arp2 / 3 kompleksining faollashtiruvchi konformatsion o'zgarishini keltirib chiqaradi.[6] Ushbu konformatsion o'zgarish tufayli NPFlar yangi aktin filamanining 70 ° burchak ostida polimerlanishini boshlaydi, bu esa harakatchan hujayralarning etakchasida xarakterli Y-shoxlangan aktin tuzilmalariga olib keladi. ActA bakteriyaning eski qutbiga joylashadi va bakterial hujayra membranasini ham, hujayra devorini ham qamrab oladi, lateral diffuziya inhibe qilinadi; shuning uchun ActA bakteriyalar yuzasida qutblangan va langarlangan holda joylashadi. Binobarin, aktin polimerizatsiyasi faqat ushbu hududda bakteriya yuzasida boshlanadi.[7] ActA ekspressioni sutemizuvchilarning xujayra hujayrasiga kirgandan keyingina paydo bo'ladi.[8]
Aktin filamenti yig'ilishi, sutemizuvchilar xost sitoplazmasidagi bakteriyani oldinga siljitadigan kuch hosil qiladi. Doimiy aktin polimerizatsiyasi sitoplazmadagi harakatlanish uchun va hattoki qo'shni hujayralarni yuqtirish uchun etarli.[9]
Tadqiqot
Yangi ma'lumotlar, ActA vakuolalarning buzilishida ham muhim rol o'ynaydi. Vakuolni o'tkazishda ActA ning o'chirilgan mutanti nuqsonli edi. Kislotali mintaqaning N-uchi (32-42) ning 11 ta aminokislotali cho'zilishi, fagosoma.[10]
Tuzilishi
Ning asosiy oqsilli mahsuloti aktA gen 639 aminokislotadan iborat va signal peptidi (birinchi N-terminal 29 aminokislotalar) va ActA zanjirini (C-terminal 610 aminokislotalar) o'z ichiga oladi. Shuning uchun etuk AktA oqsilining ketma-ketligi 610 ta aminokislotadan iborat. ActA molekulyar og'irligi 70 349 Da ni tashkil qiladi va sirt oqsili hisoblanadi.[1][2]
ActA tabiiy ravishda ochilmagan oqsil bo'lib, uni uchta funktsional sohaga bo'lish mumkin (2-rasm):[1][11][12]
- Yuqori darajada zaryadlangan N-terminal domeni: aminokislota qoldiqlari 1-234
- prolinga boy takrorlanadigan markaziy domen: aminokislotalar qoldiqlari 235-394
- Transmembranali domenli C-terminal domeni: aminokislotalar qoldiqlari 395-610
N-terminal domeni
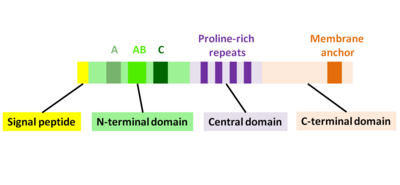
N-terminal domenining birinchi 156 aminokislotasi uchta mintaqadan iborat[10][13] (2-rasm):
- Kislota qoldiqlari cho'zilgan A-mintaqa: 32-45
- AB-mintaqasi, aktin monomerini bog'laydigan mintaqasi: 59-102
- C-mintaqasi, kofilin homologiyasi ketma-ketligi: 145-156
ActA ning N-terminal qismi aktin polimerizatsiyasida muhim rol o'ynaydi.[14] Ushbu domen, eukaryotik WASP oilasi NPFlarida mavjud bo'lgan konsensus elementlarini namoyish etadi, ular tarkibiga aktin monomer bilan bog'lanish mintaqasi, shuningdek Arp2 / 3 bog'lovchi C (markaziy yoki kofilin homologiyasi) va A (kislotali) hudud kiradi.[7] ActA ning aktin monomer bilan bog'lanish mintaqasi WASP-Homology-2 (WH2) yoki V domeni kabi funktsional xususiyatlarga ega, ammo ketma-ketligi bilan farq qiladi.[15] Shunday qilib, WASP-oilaviy NPF-larda domenlarning tartibi WH2, undan keyin C, keyin esa A bo'ladi, bu ActA-da bo'lmagan.
Markaziy domen
Proaktiv moddalarga boy bo'lgan ActA ning markaziy mintaqasi bakteriyalarning harakatchanligini ta'minlash uchun juda muhimdir. FPPPP yoki FPPIP motiflarini o'z ichiga olgan to'rtta prolin-takroriy takrorlash mavjud. Ushbu hududlar mezbon hujayra sitoskeletal oqsilini taqlid qiladi ziksin, vinkulin va paladin bilan bog'langanligi ma'lum fokal yopishqoqlik yoki stress tolalari.[16] Vazodilatator tomonidan stimulyatsiya qilingan fosfoprotein (VASP ) Ena / VASP homology 1 domeni orqali bog'lanishi mumkin (EVH1 domeni ) prolinlarga boy bo'lgan markaziy mintaqaga va yollanganlarga profilin, aktin iplarining tikanli uchlarida polimerlanishni kuchaytiradigan aktin monomerini bog'laydigan oqsil. Bundan tashqari, VASP bilan o'zaro aloqada ko'rinadi F-aktin bakteriyaning quyruq bilan bog'lanishini ta'minlaydigan karboksi-terminal EVH2 domeni orqali.[17] Ushbu bayonot, ActA bir nechta Ena / VASP oqsillarini bir vaqtning o'zida bog'lashi va ActA va Ena / VASP o'rtasida yuqori yaqinlikka ega ekanligi bilan qo'llab-quvvatlanadi. VASP in vitro aktin-Y shoxlarini chastotasini kamaytirishi va shu bilan kometa dumlarida parallel hizalanishda tashkil qilingan filamentlar ulushini oshirishi ko'rsatilgan.[18][19]
C-terminal domeni
ActA ning C-terminal domeni bakterial membranadagi oqsilni biriktiradigan hidrofobik mintaqaga ega.[20][21][22]
Xulosa qilib aytganda, bundan tashqari
- aktin bilan bog'laydigan mintaqada ketma-ketlik gomologiyasining yo'qligi va
- WASP-oilaviy NPF (V (WH2) -C-A) uchun xos bo'lgan ARP2 / 3 faollashtiruvchi domenlar ketma-ketligidagi o'zgarish,
- ActA va xost NPFlar o'rtasidagi katta farq shundaki, ActAda Rho oilasining GTPazalari kabi tartibga soluvchi oqsillarni bog'laydigan elementlar mavjud emas. ActA va xost NPFlar o'rtasidagi ushbu tizimli farq foydali bo'lishi mumkin L. monotsitogenlar va uning patogenezi, chunki aktinning nukleatsiya faolligi L. monotsitogenlar mezbon tartibga solishidan mustaqildir.[7]
Analoglar
Funktsional ravishda ActA tomonidan taqlid qilingan WASP / N-WASP, eukaryotlarda yuqori darajada saqlanib qolgan. Bu muhim aktin-sitoskelet organizatori bo'lib, endotsitoz va hujayra harakatlanishi kabi jarayonlar uchun juda muhimdir. Tomonidan faollashtirilgan CD42, Rho-oilaviy kichik GTPaza, WASP / N-WASP Arp2 / 3 kompleksini faollashtiradi, bu esa tez aktin polimerizatsiyasiga olib keladi.[23]
Boshqa patogenlarning aktin asosida harakatlanishi
Yilda Shigella oqsil IcsA faollashadi N-WASP, bu yuqtirilmagan sutemizuvchilar hujayralarida GTPase Cdc42 tomonidan faollashadi. Faol N-WASP / WASP Arp2 / 3 kompleksini faollashtirish orqali aktin polimerizatsiyasiga olib keladi. Aksincha, Listeriyalar ActA oqsili to'g'ridan-to'g'ri Arp2 / 3 kompleksi bilan ta'sir o'tkazadi va faollashtiradi.[7]
The Rikketsiya RickA oqsili, shuningdek, Arp2 / 3 kompleksini WASP-ga o'xshash tarzda faollashtirishi mumkin. Aksincha Listeriyalar, aktin iplari uzun, tarvaqaylamagan parallel to'plamlarda joylashgan. Arp2 / 3 kompleksi faqat bakteriyalar yuzasi yaqinida joylashgan va shuning uchun Arp2 / 3 kompleksidan mustaqil ravishda uzayish tez-tez sodir bo'ladi deb taxmin qilinadi.[16]
Yilda Burxolderiya pseudomallei BimA in vitro aktin polimerizatsiyasini boshlaydi. Ushbu bakteriyaning hujayra ichidagi migratsiyasi Arp2 / 3 kompleksidan mustaqil ravishda ishlaydi deb taxmin qilinadi.[16]
Shuningdek qarang
Adabiyotlar
- ^ a b v d Kocks C, Gouin E, Tabouret M, Berche P, Ohayon H, Cossart P (1992 yil fevral). "L. monotsitogenlar ta'sirida aktinni yig'ish uchun aktA geni mahsuloti, sirt oqsili kerak". Hujayra. 68 (3): 521–31. doi:10.1016 / 0092-8674 (92) 90188-I. PMID 1739966.
- ^ a b Uniprot P33379
- ^ Cossart P, Sansonetti PJ (2004 yil aprel). "Bakterial invaziya: enteroinvaziv patogenlar paradigmalari". Ilm-fan. 304 (5668): 242–8. doi:10.1126 / science.1090124. PMID 15073367.
- ^ Cossart P, Pizarro-Cerdá J, Lecuit M (yanvar 2003). "Listeria monocytogenes tomonidan sutemizuvchilar hujayralarining bosqini: uyali funktsiyalarni buzish uchun funktsional mimika". Hujayra biologiyasining tendentsiyalari. 13 (1): 23–31. doi:10.1016 / S0962-8924 (02) 00006-5. PMID 12480337.
- ^ Zigmond SH (2004 yil fevral). "Aktin iplarining formuladan kelib chiqqan yadrosi". Hujayra biologiyasidagi hozirgi fikr. 16 (1): 99–105. doi:10.1016 / j.ceb.2003.10.019. PMID 15037312.
- ^ Goley ED, Rodenbusch SE, Martin AC, Welch MD (oktyabr 2004). "Arp2 / 3 kompleksidagi kritik konformatsion o'zgarishlar nukleotid va nukleatsiyani kuchaytiruvchi omil tomonidan induktsiya qilinadi". Molekulyar hujayra. 16 (2): 269–79. doi:10.1016 / j.molcel.2004.09.018. PMID 15494313.
- ^ a b v d Gouin E, Welch MD, Cossart P (2005 yil fevral). "Hujayra ichidagi qo'zg'atuvchilarning aktin asosida harakatlanishi". Mikrobiologiyaning hozirgi fikri. 8 (1): 35–45. doi:10.1016 / j.mib.2004.12.013. PMID 15694855.
- ^ Rafelski SM, Theriot JA (2006 yil fevral). "Listeria monocytogenes sirt oqsili ActA ning qutblanish mexanizmi". Molekulyar mikrobiologiya. 59 (4): 1262–79. doi:10.1111 / j.1365-2958.2006.05025.x. PMC 1413586. PMID 16430699.
- ^ Goldberg MB (2001 yil dekabr). "Hujayra ichidagi mikrobial patogenlarning aktinga asoslangan harakatlanishi". Mikrobiologiya va molekulyar biologiya sharhlari. 65 (4): 595–626. doi:10.1128 / MMBR.65.4.595-626.2001. PMC 99042. PMID 11729265.
- ^ a b Pussin MA, Goldfine H (2010 yil yanvar). "Listeria monocytogenes fagosomasining pishib etishida ActA ning ishtiroki uchun dalillar". Hujayra tadqiqotlari. 20 (1): 109–12. doi:10.1038 / cr.2009.142. PMC 2802179. PMID 20029388.
- ^ Ireton K, Cossart P (1997). "Listeria monocytogenesning kirish va aktin asosida harakatlanishi paytida xost-patogenning o'zaro ta'siri". Genetika fanining yillik sharhi. 31: 113–38. doi:10.1146 / annurev.genet.31.1.113. PMID 9442892.
- ^ Footer, Metyu J.; Lyo, Jon K.; Theriot, Julie A. (2008-08-29). "Listeria monocytogenes ActA, tabiiy ravishda buklanmagan oqsil, F-aktin birikmasini dimerizatsiya qilmasdan yaxshilaydi". Biologik kimyo jurnali. 283 (35): 23852–23862. doi:10.1074 / jbc.M803448200. ISSN 0021-9258. PMC 2527104. PMID 18577520.
- ^ Welch, Metyu D. (2007). "Listeriya monotsitogenlarining aktin asosida harakatlanishi va hujayradan hujayraga tarqalishi". Goldfaynda, Xovard; Shen, Xao (tahrir). Listeria monocytogenes: Patogenezi va mezbonning reaktsiyasi. Nyu-York: Springer. 197-223 betlar. doi:10.1007/978-0-387-49376-3_10. ISBN 978-0-387-49373-2.
- ^ Welch MD, Rosenblatt J, Skoble J, Portnoy DA, Mitchison TJ (iyul 1998). "Aktin filament yadrosidagi inson Arp2 / 3 kompleksi va Listeria monocytogenes ActA oqsilining o'zaro ta'siri". Ilm-fan. 281 (5373): 105–8. doi:10.1126 / science.281.5373.105. PMID 9651243.
- ^ Zalevskiy J, Grigorova I, Mullins RD (fevral, 2001). "Listeria acta oqsili bilan Arp2 / 3 kompleksining faollashishi. Acta Arp2 / 3 kompleksining ikkita aktin monomerini va uchta kichik birligini birlashtiradi". Biologik kimyo jurnali. 276 (5): 3468–75. doi:10.1074 / jbc.M006407200. PMID 11029465.
- ^ a b v Lambrechts A, Gevaert K, Cossart P, Vandekerckhove J, Van Troys M (may 2008). "Listeria kuyruklu yulduzi quyruqlari: ishda aktinga asoslangan harakat mexanizmlari". Hujayra biologiyasining tendentsiyalari. 18 (5): 220–7. doi:10.1016 / j.tcb.2008.03.001. PMID 18396046.
- ^ Laurent V, Loisel TP, Harbeck B va boshq. (1999 yil mart). "Listeria monotsitogenlarining aktin asosida harakatlanishida Ena / VASP oilasi oqsillarining roli". Hujayra biologiyasi jurnali. 144 (6): 1245–58. doi:10.1083 / jcb.144.6.1245. PMC 2150578. PMID 10087267.
- ^ Skoble J, Auerbuch V, Goley ED, Welch MD, Portnoy DA (oktyabr 2001). "Arp2 / 3 kompleks-vositachilikli aktin nukleatsiyasi, aktin novdasining shakllanishi va Listeria monocytogenes harakatchanligidagi VASP ning muhim roli". Hujayra biologiyasi jurnali. 155 (1): 89–100. doi:10.1083 / jcb.200106061. PMC 2150787. PMID 11581288.
- ^ Bear JE, Svitkina TM, Krause M va boshq. (2002 yil may). "Ena / VASP oqsillari va aktin filamanining qoplanishi o'rtasidagi ziddiyat fibroblastning harakatlanishini tartibga soladi". Hujayra. 109 (4): 509–21. doi:10.1016 / S0092-8674 (02) 00731-6. hdl:1721.1/83477. PMID 12086607.
- ^ Vazquez-Boland JA, Kocks C, Dramsi S va boshq. (1992 yil yanvar). "Listeria monocytogenes lesitinaza operonining nukleotidlar ketma-ketligi va hujayradan hujayraga tarqalishda lesitinazaning mumkin bo'lgan o'rni". Infektsiya va immunitet. 60 (1): 219–30. PMC 257526. PMID 1309513.
- ^ Domann E, Wehland J, Rohde M va boshq. (1992 yil may). "Listeriya monotsitogenlaridagi yangi bakterial virulentlik geni, vinkulinning prolinga boy mintaqasiga homologiya bilan xujayra mikrofilamentining o'zaro ta'siri uchun zarur". EMBO jurnali. 11 (5): 1981–90. doi:10.1002 / j.1460-2075.1992.tb05252.x. PMC 556658. PMID 1582425.
- ^ Kocks C, Hellio R, Gounon P, Ohayon H, Cossart P (1993 yil iyul). "Listeria monocytogenes sirt oqsili ActA ning yo'naltirilgan aktin yig'ilish joyida polarizatsiyalangan tarqalishi". Hujayra fanlari jurnali. 105 (3): 699–710. PMID 8408297.
- ^ Kurisu S, Takenava T (2009). "WASP va WAVE oilaviy oqsillari". Genom biologiyasi. 10 (6): 226. doi:10.1186 / gb-2009-10-6-226. PMC 2718491. PMID 19589182.
Tashqi havolalar
- YouTube videosi dan Tabiat, Listeriya monotsitogenlari [2:00–4:12]
