Kinurenin 3-monooksigenaza - Kynurenine 3-monooxygenase
| kinurenin 3-monooksigenaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 4J34 dan hosil bo'lgan kinurenin 3-monooksigenaza dimerining tuzilishi.[1] Bitta monomer multfilm formatida (moviy), ikkinchi monomer lenta formatida (yashil) tasvirlangan. Moslashuvchan bog'lovchi hududlar (96-104 qoldiqlari) qizil rangga bo'yalgan. Flavin adenin dinukleotidi (FAD) atom turiga ko'ra rang bilan kodlangan shar shaklida ko'rsatilgan. | |||||||||
| Identifikatorlar | |||||||||
| EC raqami | 1.14.13.9 | ||||||||
| CAS raqami | 9029-61-2 | ||||||||
| Ma'lumotlar bazalari | |||||||||
| IntEnz | IntEnz ko'rinishi | ||||||||
| BRENDA | BRENDA kirish | ||||||||
| ExPASy | NiceZyme ko'rinishi | ||||||||
| KEGG | KEGG-ga kirish | ||||||||
| MetaCyc | metabolik yo'l | ||||||||
| PRIAM | profil | ||||||||
| PDB tuzilmalar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontologiyasi | AmiGO / QuickGO | ||||||||
| |||||||||
Yilda enzimologiya, a kinurenin 3-monooksigenaza (EC 1.14.13.9 ) an ferment bu kataliz qiladi The kimyoviy reaktsiya
- L-kinurenin + NADPH + H+ + O2 ⇌ 3-gidroksi-L-kinurenin + NADP+ + H2O
Kinurenin 3-monooksigenaza - ning ekspression hosilasi KMO (gen). The sistematik ism bu fermentlar sinfiga kiradi L-kinurenin, NADPH: kislorod oksidoreduktaza (3-gidroksilat). Umumiy foydalanishdagi boshqa nomlarga quyidagilar kiradi kinurenin 3-gidroksilaza, kinurenin gidroksilazava L-kinurenin-3-gidroksilaza. U ishtirok etadi triptofan metabolizmi orqali kinurenin katabolik yo'li. Ushbu ferment. Oilasiga tegishli oksidoreduktazalar, aniqrog'i, juft donorlarga ta'sir ko'rsatadiganlar, bilan O2 oksidlovchi sifatida. Kinurenin 3-monooksigenaza kinureninning aromatik halqasiga molekulyar kislorod kiritilishini katalizlaydi va 3-gidroksi- hosil qiladi.L-kinurenin.[2] U bitta ishlaydi kofaktor, FAD. Kinurenin 3-monooksigenaza kinurenin yo'lidagi muhim tarmoq bo'lib xizmat qiladi va natijada jozibador dori vositasi hisoblanadi. immunologik, neyrodejenerativ va neyroinflamatuar kasalliklar.[3] Hozirgi vaqtda kinurenin 3-monooksigenaza fermenti bo'yicha ko'plab tadqiqotlar birinchi navbatda yo'naltirilgan kalamush modellar[4] va xamirturush,[5] ikkalasi ham yuqori ketma-ketlikka ega ekanligi namoyish etildi homologiya inson kinurenin 3-monooksigenaza oqsili bilan. Tadqiqotlar ushbu ökaryotik kinurenin 3-monooksigenaza faol joylarida ferment inhibisyonunun foydali ta'sirini ko'rsatdi, shuning uchun bu ferment insonning dizayni uchun jozibali maqsadga aylandi.[3][5]
Tuzilishi
Kinurenin 3-monooksigenaza bu a dimer assimetrik o'z ichiga oladi subbirliklar[5] va protez guruhi sifatida bitta FAD-majburiy domeniga ega.[3] Kinurenin 3-monooksigenaza antiparallelning ikkinchi ipidan keyin substratni bog'lashda ishtirok etadigan bog'lovchi mintaqani o'z ichiga oladi. b-varaq, olti qatorli antiparallel b varaqli domen va an a-spiral karboksi-terminalda.[5] The hidrofob C-terminusi mitoxondriyali biriktiruvchi domen vazifasini bajaradi va fermentativ faollikda ishtirok etadi.[6]
Faol sayt
Hech bir ilmiy adabiyotda kinurenin 3-monooksigenaza kompleksining kristalli tasviri haqida xabar berilmagan L-kinurenin, UPF 648 bilan birgalikda kristallangan xamirturush tarkibidagi fermentning strukturaviy tadqiqotlari FAD kofaktori va substratining faol joyda qanday bog'langanligini aniqlaydi.[1] UPF 648 va kimyoviy kimyoviy o'xshashliklar L-kinurenin substratning yonma-yon bog'lanishini taklif qiladi Qayta- yuz flavoprotein. Pro qoldiqlarini o'z ichiga olgan pastadir321–Gln325 FAD protez guruhining yon tomonidagi kislorod bilan bog'lanish joyi deb ishoniladi.[5]
Har bir monomerda konservalangan gidrofob cho'ntak (Leu qoldiqlari) mavjud221, Met230, Ile232, Leu234, Phe246, Pro321, Phe322) substratning aromatik benzol qismi atrofida joylashgan.[5] Himoyalangan Gln325 qutb qoldig'i, shuningdek, vodorod bilan bog'lanishda ishtirok etadi L-kinurenin karbonil guruhi, shuningdek FAD N3 atomidagi vodorodda.[1] Arg83 va Tyr97 shuningdek, substratdagi aminokislota qismidagi karboksilat bilan qutbli aloqa hosil qiladi.[7]
Mexanizm
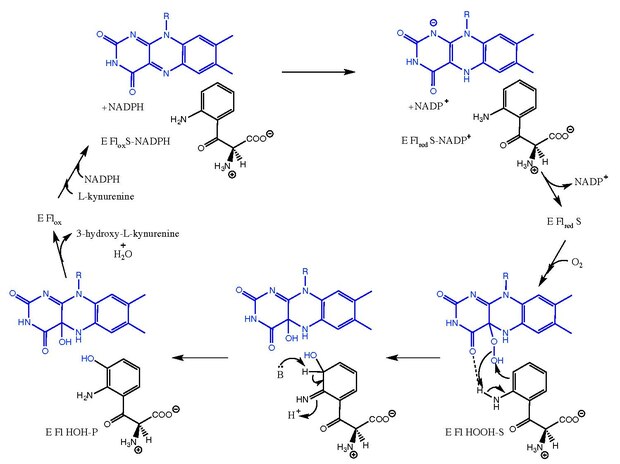
Kinurenin-3-monooksigenaza katalizlaydi gidroksillanish ning L-kinurenindan 3-gidroksigacha-L-Kinurenin NADPH ning NADP bilan o'zaro almashinuvi bilan+. Reaksiya mexanizmi umuman ma'lum emas, lekin bilan bog'liq mexanizmlarga amal qiladi deb ishoniladi flavinga bog'liq monooksigenazlar.[8] Keyin L-kinurenin birikadi, NADPH FADni kamaytiradi va NADP bo'lib chiqadi+. Keyin kislorod bog'lanib, hosil bo'ladi L-kinurenin-FAD-gidroperoksid oralig'i.[5][9] Ushbu oraliq gidroksilatsiya reaktsiyasi uchun elektrofil manba bo'lib, birlamchi hosil qiladi ketimin mahsulot shakli va C4a-gidroksi-FAD.[10] Tautomerizatsiya natijasida 3-gidroksi- hosil bo'ladi.L-kinurenin ferment bilan kompleksda (E Fl HOH-P). 3-gidroksi- ning ajralishiL-kinurenin va H2O erkin fermentga olib keladi (E Flho'kiz).
Biologik funktsiya
Kinurenin 3-monooksigenaza konversiyani katalizlaydi L-kinurenindan 3-gidroksigacha-Ltarkibidagi muhim bioaktiv metabolit - kinurenin kinurenin yo'li. Kinurenin yo'lining 95% dan ortig'i javobgardir triptofan oksidlanish degradatsiyasi.[11] L-Kinurenin ushbu metabolik yo'lning muhim bo'lagi bo'lib, unga aylanadi neyrotoksin 3-gidroksi-L-kinurenin kinurenin 3-monooksigenaza orqali, neyroprotektor kinurenik kislota kinurenin amino transferazlari orqali yoki antranil kislotasi tomonidan kinureninaza.[12]
Kinurenin 3-monooksigenaza quyi oqimdagi ishlab chiqarishni tartibga soladi kinolinik kislota reaktiv erkin radikallarni hosil qilishi mumkin[13] va faollashtiradi NMDA sutemizuvchilarning markaziy asab tizimida eksitotoksik shikastlanishlarni keltirib chiqaradigan glutamat retseptorlari subtipasi.[14][15] Kinolinik kislota, shuningdek, NADning bioprektoridir+.[12]
Kinurenin 3-monooksigenazni inhibe qilish kinurenin yo'lida kinurenik kislota ko'payishiga olib keladi. Ushbu metabolit an antagonist ning a7 nikotinik atsetilxolin retseptorlari va sifatida antagonist NMDA retseptorlari glitsinida.[16] Natijada, kinurenin 3-monooksigenaza fermentidagi regulyatsiya kinurenin yo'lining neyrotoksik va neyroprotektiv potentsialini aniqlaydi.
Kasallikning dolzarbligi
Kynurenine 3-monooxygenase - bu bir nechta neyrodejenerativ va neyroinflamatuar kasalliklar, ayniqsa, jozibali dori vositasi. Xantingtonniki, Altsgeymer va Parkinson kasalligi. Kuchli ferment inhibitörlerinin administratsiyasi istiqbolli farmakologik natijalarni ko'rsatdi.[3][5] Xususan, kinurenin 3-monooksigenaza fermentini genetik ravishda yo'q qilish, uning toksikligini bostirishi isbotlangan. ov qilish xamirturush tarkibidagi oqsil[17] va Drosophila[18] Xantington kasalligining modellari.
Genetik sabab bo'lishi mumkin bo'lgan kinurenin 3-monooksigenaza etishmovchiligi polimorfizmlar, sitokinlar yoki ikkalasi ham,[19] to'planishiga olib keladi kinurenin va triptofan ichidagi siljishga metabolik yo'l kinurenik kislota tomon va antranil kislotasi. Yaqinda o'tkazilgan tadqiqotlar shuni ko'rsatadiki, giperfiziologik kontsentratsiyasi kinurenin kinurenin 3-monooksigenaza etishmovchiligi bo'lgan bemorlarda kinurenik kislota ishlab chiqarish tomon siljishga olib keladi, bu kognitiv nuqsonlar bilan bog'liq bashorat qilish va visuospatial ish xotirasi.[20] Kinurenin-3-monooksigenaza etishmovchiligi miyaning buzilishi bilan bog'liq (masalan, shizofreniya, tik kasalliklari ) va jigar.[21][22][23][24][25]
Adabiyotlar
- ^ a b v Amaral, M. (2014). "Kinurenin 3-monooksigenazning kristalli tuzilishi - 394 holatda kesilgan va uning yorlig'i ajratilgan". doi:10.2210 / pdb4j34 / pdb. Iqtibos jurnali talab qiladi
| jurnal =(Yordam bering) - ^ Filippini, Graziella Allegri; Kosta, Karlo V. L.; Bertazzo, Antonella; Triptofan tadqiqotlari bo'yicha xalqaro uchrashuv (1998). "Triptofan tadqiqotidagi so'nggi yutuqlar: triptofan va serotonin yo'llari". Eksperimental tibbiyot va biologiyaning yutuqlari. 398. doi:10.1007/978-1-4613-0381-7. ISBN 978-1-4613-8026-9. S2CID 38080353.
- ^ a b v d Smit, Jeyson R.; Jeymi, Joan F.; Guillemin, Gilles J. (fevral, 2016). "Kinurenin-3-monooksigenaza: tuzilishi, mexanizmi va inhibitörlerini qayta ko'rib chiqish". Bugungi kunda giyohvand moddalarni kashf etish. 21 (2): 315–324. doi:10.1016 / j.drudis.2015.11.001. ISSN 1359-6446. PMID 26589832.
- ^ Shox, U .; Ullrich, V .; Staudinger, H.J (1971). "Tozalash va tavsiflash L-chinurenin 3-gidroksilaza (EC 1.14.1.2.) kalamush jigaridan ". Hoppe-Seylerning Z. Fiziol. Kimyoviy. 352 (6): 837–842. doi:10.1515 / bchm2.1971.352.1.837. PMID 5087636.
- ^ a b v d e f g h men Amaral, M; Levi, C; Heyes, DJ; Lafit, P; Outeiro, TF; Giorgini, F; Leys, D; Scrutton, NS (2013). "Kinurenin 3-monooksigenaza inhibisyonunun strukturaviy asoslari". Tabiat. 496 (7445): 382–385. Bibcode:2013 yil Noyabr 499..382A. doi:10.1038 / tabiat12039. PMC 3736096. PMID 23575632.
- ^ Xirai KH va boshq. (2010). "Cho'chqa jigarining karboksil-terminal mintaqasining ikki tomonlama roli L-kinurenin 3-monooksigenaza: mitoxondriyal-nishonga olish signali va fermentativ faollik ". J. Biokimyo. 148 (6): 639–650. doi:10.1093 / jb / mvq099. PMID 20802227.
- ^ Mole D va boshq. (2016). "Kinurenin-3-monooksigenaza inhibatsiyasi o'tkir pankreatitning kemiruvchilar modellarida ko'p organ etishmovchiligini oldini oladi". Tabiat tibbiyoti. 22 (2): 202–209. doi:10.1038 / nm.4020. PMC 4871268. PMID 26752518.
- ^ Breton, J .; va boshq. (2000). "Rekombinant odam kinurenin 3-gidroksilaza funktsional tavsifi va ta'sir mexanizmi". Yevro. J. Biokimyo. 267 (4): 1092–1099. doi:10.1046 / j.1432-1327.2000.01104.x. PMID 10672018.
- ^ a b Krozye-Reab, KR; va boshq. (2008). "Kinurenin 3-monooksigenaza Pseudomonas floresanlari: substratga o'xshash inhibitorlar flavinning kamayishini rag'batlantiradi va flavin-perokso oralig'ini barqarorlashtiradi, ammo vodorod peroksid hosil bo'lishiga olib keladi ". Biokimyo. 47 (47): 12420–12433. doi:10.1021 / bi8010434. PMID 18954092.
- ^ a b Entsch B va boshq. (1976). "Ning gidroksillanishida ishtirok etadigan flavin-kislorod hosilalari p-gidroksibenzoat gidroksilaza ". J. Biol. Kimyoviy. 251 (9): 2550–2563. PMID 816794.
- ^ Thevandavakkam MA va boshq. (2010). "Kinurenin 3-monooksigenazni (KMO) nishonga olish. Xantington kasalligida terapiyaning ta'siri". CNS neyroli. Tartibsizlik. Giyohvand moddalarga qarshi maqsadlar. 9 (6): 791–800. doi:10.2174/187152710793237430. PMID 20942784.
- ^ a b Giorgini F, Huang SY, Sathyasaikumar KV va boshqalar. (2013). "Sichqonlarda kinurenin 3-monooksigenazani maqsadli ravishda yo'q qilish: periferiya va miyada kinurenin yo'lining metabolizmini o'rganish uchun yangi vosita". Biologik kimyo jurnali. 288 (51): 36554–36566. doi:10.1074 / jbc.M113.503813. PMC 3868768. PMID 24189070.
- ^ Rios, C .; Santamaria, A. (1991). "Kinolinik kislota kalamush miya homogenatlaridagi kuchli lipid peroksidantidir". Neyrokim. Res. 16 (10): 1139–1143. doi:10.1007 / bf00966592. PMID 1686636. S2CID 28669340.
- ^ Tosh, T. V.; Perkins, M. N. (1981). "Kinolinik kislota: CNS tarkibidagi aminokislota retseptorlari ta'sirida kuchli endogen qo'zg'atuvchi". Yevro. J. Farmakol. 72 (4): 411–412. doi:10.1016/0014-2999(81)90587-2. PMID 6268428.
- ^ Shvarts, R .; Bruno, J. P .; Muchovskiy, P. J.; Vu, H. Q. (2012). "Sutemizuvchilar miyasidagi kinureninlar. Fiziologiya patologiya bilan uchrashganda". Nat. Vahiy Neurosci. 13 (7): 465–477. doi:10.1038 / nrn3257. PMC 3681811. PMID 22678511.
- ^ Hilmas, C .; Pereyra, E. F.; Alkondon, M .; Rasulpur, A .; Shvarts, R .; Albukerke, E. X. (2001). "Miya metabolit kinurenik kislota a7 nikotinik retseptorlari faoliyatini inhibe qiladi va a7 bo'lmagan nikotinik retseptorlari ekspressionini oshiradi: fiziopatologik ta'sirlar". J. Neurosci. 21 (19): 7463–7473. doi:10.1523 / JNEUROSCI.21-19-07463.2001. PMC 6762893. PMID 11567036.
- ^ Giorgini, F.; Gvidetti, P.; Nguyen, Q .; Bennett, S. C .; Muchovskiy, P. J. (2005). "Xamirturushdagi genomik skrining kinurenin 3-monooksigenazni Xantington kasalligi uchun terapevtik nishonga aylantiradi". Nat. Genet. 37 (5): 526–531. doi:10.1038 / ng1542. PMC 1449881. PMID 15806102.
- ^ Kempesan, S .; Yashil, E. V.; Breda, C .; Sathyasaykumar, K. V.; Muchovskiy, P. J.; Shvarts, R .; Kyriacou, C. P.; Giorgini, F (2011). "Kinurenin yo'li a-da neyrodejeneratsiyani modulyatsiya qiladi Drosophila Xantington kasalligining modeli ". Curr. Biol. 21 (11): 961–966. doi:10.1016 / j.cub.2011.04.028. PMC 3929356. PMID 21636279.
- ^ Myuller, N; Myint, AM; Schwarz, MJ (2010). "Yallig'lanishli biomarkerlar va depressiya". Neyrotoks. Res. 19 (2): 308–318. doi:10.1007 / s12640-010-9210-2. PMID 20658274. S2CID 3225744.
- ^ Wonodi I, Colin-Stine O, Sathyasaikumar KV va boshq. (2011). "Shizofreniya va shizofreniya endofenotiplari bilan genetik assotsiatsiyada regulyatsiya qilingan kinurenin 3-monooksigenaza gen ekspressioni va ferment faolligi". Arch Gen Psixiatriya. 68 (7): 665–674. doi:10.1001 / archgenpsychiatry.2011.71. PMC 3855543. PMID 21727251.
- ^ Holtze M, Saetre P, Engberg G va boshq. (2012). "Kinurenin 3-monooksigenaza polimorfizmlari: shizofreniya va sog'lom nazorat ostida bemorlarda kinurenik kislota sintezi uchun dolzarbligi". J Psixiatriya Neurosci. 37 (1): 53–57. doi:10.1503 / jpn.100175. PMC 3244499. PMID 21693093.
- ^ Kempbell, Brayan M.; Charich, Erik; Li, Anna V.; Möller, Tomas (2014). "KSN kasalligida kinureninlar: yallig'lanishli sitokinlarni boshqarish". Nevrologiya chegaralari. 8 (12): 12. doi:10.3389 / fnins.2014.00012. PMC 3915289. PMID 24567701.
- ^ Hoekstra, PJ; Anderson, GM; Troost, PW (2007). "Tik buzilishi bo'lgan bemorlarda plazmadagi kinurenin va shunga o'xshash choralar". Eur bolalar o'smirlari psixiatriyasi. 16 (Qo'shimcha 1): 71-77. doi:10.1007 / s00787-007-1009-1. PMID 17665285. S2CID 39150343.
- ^ Buness A, Roth A, Herrmann A, Shmitz O, Kamp H va boshq. (2014). "Gepatotoksiklik bilan bog'liq bo'lgan metabolitlarni, kimyoviy kimyoviy markerlarni va transkriptlarni aniqlash". PLOS ONE. 9 (5): e97249. Bibcode:2014PLoSO ... 997249B. doi:10.1371 / journal.pone.0097249. PMC 4023975. PMID 24836604.
- ^ Yukiko, Xirata; Takashi, Kavachi; Takashi, Sugimura (2 oktyabr 1967). "In'ektsiya yo'li bilan jigar yog'i L-triptofan ". Biochimica et Biofhysica Acta (BBA) - Lipidlar va lipidlar almashinuvi. 144 (2): 233–241. doi:10.1016/0005-2760(67)90153-1. PMID 4168935.
- Foucher AL, McIntosh A, Douce G, Wastling J, Tait A, Turner CM (2006). "Trypanosoma bruseydagi arsenik preparatlarga chidamliligini proteomik tahlil qilish". Proteomika. 6 (9): 2726–2732. doi:10.1002 / pmic.200500419. PMID 16526094. S2CID 24074942.
- Okamoto H, Hayaishi O (1967). "Sichqoncha jigar mitoxondriyasining kinurenin gidroksilaza uchun Flavin adenin dinukleotidga bo'lgan ehtiyoji". Biokimyo. Biofiz. Res. Kommunal. 29 (3): 394–399. doi:10.1016 / 0006-291X (67) 90469-X. PMID 6076241.
- Saito Y, Hayaishi O, Rothberg S (1957). "Kislorodni o'rganish; 3-gidroksi- ning fermentativ shakllanishiL-kinurenin L-kinurenin ". J. Biol. Kimyoviy. 229 (2): 921–934. PMID 13502353.