Raney nikeli - Raney nickel
 Quruq faollashtirilgan Raney nikeli | |
| Identifikatorlar | |
|---|---|
| UNII | |
| Xususiyatlari | |
| Tashqi ko'rinish | Ochiq kulrang kukun |
| Xavf | |
| GHS piktogrammalari |    |
| H250, H317, H351, H372, H412 | |
| P210, P273, P280, P302 | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Raney nikeli /ˈreɪniːˈnɪkal/deb nomlangan shimgichli nikel,[1] asosan tarkib topgan mayda donali qattiq moddadir nikel nikeldan olingan -alyuminiy qotishma.[2][3] Bir nechta navlari ma'lum, ularning aksariyati kulrang qattiq moddalardir. Ba'zilar piroforik, ko'plari havoga chidamli atala sifatida ishlatiladi. Raney nikeli reaktiv sifatida va katalizator sifatida ishlatiladi organik kimyo. U 1926 yilda amerikalik muhandis tomonidan ishlab chiqilgan Myurrey Raney uchun gidrogenlash o'simlik moylari.[4][5]
Nomenklatura
Raney ro'yxatdan o'tgan savdo belgisidir W. R. Grace va Company, faqat uning Grace Division tomonidan ishlab chiqarilgan mahsulotlar "Raney nickel" deb nomlangan. "Skelet katalizatori" yoki "shimgichni metall katalizatori" degan umumiy atamalar fizikaviy va kimyoviy xossalari bilan Raney nikeliga o'xshash katalizatorlarni nazarda tutishi mumkin. Biroq, Grace kompaniyasining o'zi etkazib beradigan katalizatorlar uchun umumiy nomlardan foydalanmaganligi sababli,[6] "Raney" AQSh davrida umumiy bo'lishi mumkin savdo belgisi to'g'risidagi qonun.[iqtibos kerak ]
Tayyorgarlik
Qotishma tayyorlash

Ni-Al qotishmasi nikelni eritilgan alyuminiyda eritib, so'ng sovutish ("söndürme") bilan tayyorlanadi. Ni: Al nisbatiga qarab, söndürme turli xil fazalarni hosil qiladi, söndürme jarayonida, katalizatorning faolligini oshirish uchun ozgina miqdorda uchinchi metall, masalan, sink yoki xrom qo'shiladi. Ushbu uchinchi metall "targ'ibotchi ".[7] Promouter aralashmani ikkilik qotishmadan uchlik qotishmasiga o'zgartiradi, bu esa faollashganda turli xil söndürme va eritish xususiyatlariga olib kelishi mumkin.
Faollashtirish
Aktivizatsiya jarayonida qotishma, odatda mayda kukun sifatida, ning konsentrlangan eritmasi bilan ishlanadi natriy gidroksidi.[3] Suyultirilgan sodalashtirish reaktsiyasi quyidagicha berilgan kimyoviy tenglama:
- 2 Al + 2 NaOH + 6 H2O → 2 Na [Al (OH)4] + 3 H2
Shakllanishi natriy aluminat (Na [Al (OH))4]) hosil bo'lishining oldini olish uchun yuqori konsentratsiyali natriy gidroksid eritmalaridan foydalanishni talab qiladi alyuminiy gidroksidi, aks holda bu kabi cho'kindi bayerit.[7] Shuning uchun 5 gacha konsentratsiyali natriy gidroksid eritmalariM ishlatiladi.
Qotishma eritmasi uchun ishlatiladigan harorat katalizatorning xususiyatlariga sezilarli ta'sir ko'rsatadi. Odatda, yuvinish 70 dan 100 ° C gacha. Reyney nikelining yuzasi (va umuman, unga bog'liq katalizatorlar) yuvinish haroratining oshishi bilan pasayish tendentsiyasiga ega.[8] Bu shunga o'xshash deb hisoblanishi mumkin bo'lgan qotishma ichidagi tuzilmalarni qayta tuzish bilan bog'liq sinterlash, bu erda qotishma ligamentlari yuqori haroratda bir-biriga yopishib, g'ovakli strukturaning yo'qolishiga olib keladi.[iqtibos kerak ]
Aktivizatsiya jarayonida Al NiAl dan chiqib ketadi3 va Ni2Al3 qotishmada mavjud bo'lgan fazalar, Ni ko'p qismi esa NiAl shaklida qoladi. Alning ba'zi fazalardan chiqarilishi, boshqalari esa ma'lum emas "selektiv eritma ". NiAl fazasi katalizatorning strukturaviy va termal barqarorligini ta'minlaydi. Natijada katalizator parchalanishga ancha chidamli (" buzilish ", odatda" qarish "deb nomlanadi).[8] Ushbu qarshilik Raney nikelini uzoq vaqt davomida saqlashga va qayta ishlatishga imkon beradi; ammo, laboratoriyada foydalanish uchun odatda yangi preparatlar afzallik beriladi.[9] Shu sababli, tijorat Raney nikeli ham "faol", ham "faol bo'lmagan" shaklda mavjud.
Saqlashdan oldin katalizatorni atrofdagi haroratda distillangan suv bilan yuvish mumkin, qolgan natriy aluminatini olib tashlash uchun. Kislorodsiz (gazsizlangan ) oldini olish uchun suv saqlash uchun afzaldir oksidlanish qarish jarayonini tezlashtiradigan va katalitik faollikni pasayishiga olib keladigan katalizatorning[7]
Xususiyatlari



Makroskopik tarzda Raney nikeli mayda bo'lingan, kulrang kukundir. Mikroskopik jihatdan ushbu kukunning har bir zarrasi uch o'lchovlidir mash, tartibsiz kattalik va shakldagi g'ovaklar bilan, ularning aksariyati eritma jarayonida hosil bo'ladi. Raney nikeli termal va strukturaviy barqarorligi bilan bir qatorda katta bo'lganligi bilan ajralib turadi Brunauer -Emmet -Teller (Garov ) sirt maydoni. Ushbu xususiyatlar aktivizatsiya jarayonining bevosita natijasidir va nisbatan yuqori katalitik faollikka yordam beradi.[iqtibos kerak ]
Sirt maydoni odatda BET o'lchovi bilan aniqlanadi, masalan, metall yuzalarga adsorbsiyalangan gaz yordamida. vodorod. Ushbu turdagi o'lchov yordamida katalizator zarrachasidagi deyarli barcha ochiq maydonlar yuzasida Ni borligi isbotlangan.[7] Ni katalizatorning faol metali bo'lganligi sababli, katta Ni sirt maydoni reaktsiyalarning bir vaqtning o'zida sodir bo'lishi uchun katta sirt mavjudligini nazarda tutadi va bu katalizatorning faolligini oshiradi. Savdoga qo'yilgan Raney nikelining o'rtacha yuzasi 100 m ni tashkil qiladi2 gramm katalizatorga.[7]
Vodorod bo'lganligi bilan birga yuqori katalitik faollik so'riladi aktivlashtirish paytida katalizatorning teshiklari ichida, Raney nikelini ko'pchilik uchun foydali katalizatorga aylantiradi gidrogenlash reaktsiyalar. Uning konstruktiv va issiqlik barqarorligi (ya'ni yuqori haroratda parchalanmaydi) uni keng reaksiya sharoitida ishlatishga imkon beradi.[10][11] Bundan tashqari, eruvchanlik eng keng tarqalgan laboratoriya erituvchilarida Raney nikelining ahamiyati yo'q, bundan mustasno mineral kislotalar masalan, xlorid kislota va uning nisbatan yuqori zichligi (taxminan 6,5 g sm)−3)[1] reaktsiya tugagandan so'ng uni suyuq fazadan ajratishni ham osonlashtiradi.
Ilovalar
Raney nikeli ko'plab sanoat jarayonlarida va organik sintez uning barqarorligi va xona haroratida yuqori katalitik faolligi tufayli.[7][12][13]
Sanoat dasturlari
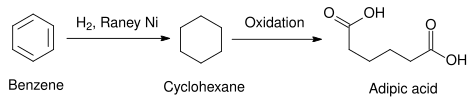
Sanoatdagi Raney nikelidan foydalanishning amaliy namunasi quyidagi reaktsiyada ko'rsatilgan, bu erda benzol bu kamaytirilgan ga sikloheksan. Benzol halqasini kamaytirishga boshqa kimyoviy vositalar orqali erishish juda qiyin, ammo uni Raney nikelidan foydalanish mumkin. Boshqa heterojen katalizatorlar, masalan foydalanadiganlar platina guruhi elementlar, o'rniga shunga o'xshash ta'sir ko'rsatishi mumkin, ammo ularni ishlab chiqarish Raney nikeliga qaraganda ancha qimmat. Shunday qilib ishlab chiqarilgan sikloheksan sintezida ishlatilishi mumkin adipik kislota, ning sanoat ishlab chiqarishida ishlatiladigan xom ashyo poliamidlar neylon kabi.[14]
Raney nikelining boshqa sanoat dasturlariga quyidagilar kiradi:
- Dekstroz ga sorbitol;
- Nitro birikmalari ga ominlar, masalan, 2,4-dinitrotoluol 2,4-toluenediaminga;
- Nitrillar aminlarga, masalan, stearonitrildan stearilamingacha va adiponitril ga geksametilendiamin;
- Olefinlar ga kerosinlar, masalan, sulfolen ga sulfolan;
- Asetilenlar kerosinlarga, masalan, 1,4-butinediol ga 1,4-butandiol.
Organik sintezdagi dasturlar
Desulfurizatsiya
Raney nikeli uchun organik sintezda ishlatiladi desulfurizatsiya. Masalan, tioatsetallar ning oxirgi bosqichida uglevodorodlarga kamayadi Mozingoning kamayishi:[14][15]

Tiollar,[16] va sulfidlar[17] dan olib tashlanishi mumkin alifatik, aromatik, yoki heteroaromatik birikmalar. Xuddi shunday, Raney nikeli ham oltingugurtni yo'q qiladi tiofen to'yingan berish alkan.[18]

Funktsional guruhlarni qisqartirish
Bu odatda kamaytirish bilan birikmalar bir nechta obligatsiyalar, kabi alkinlar, alkenlar,[19] nitrillar,[20] dienlar, aromatik moddalar[21] va karbonil - tarkibidagi birikmalar. Bundan tashqari, Raney nikeli heteroatom-heteroatom aloqalarini kamaytiradi, masalan gidrazinlar,[22] nitro guruhlar va nitrosaminlar.[23] Bundan tashqari, u reduktivda foydalanishni topdi alkillanish ning ominlar[24] va aminatsiya spirtli ichimliklar.
Uglerod-uglerodli juft bog'lanishni kamaytirganda, Raney nikeli a tarkibiga vodorod qo'shadi sin moda.[14]
Xavfsizlik


Katta sirt maydoni va tarkibidagi vodorod gazining katta miqdori tufayli quruq, faollashtirilgan Raney nikeli a piroforik ostida ishlov berishni talab qiladigan material inert atmosfera. Raney nikeli odatda 50% sifatida etkazib beriladi atala suvda. Reaktsiyadan keyin ham qoldiq Raney nikelida vodorod gazining katta miqdori mavjud va havo ta'sirida o'z-o'zidan yonib ketishi mumkin.[25]
Bundan tashqari, Raney nikelining o'tkir ta'sirida nafas olish yo'llari va burun bo'shliqlari tirnash xususiyati keltirib chiqarishi mumkin o'pka fibrozi agar nafas olayotgan bo'lsa. Qabul qilish konvulsiyalarga va ichak buzilishiga olib kelishi mumkin. Bundan tashqari, ko'z va terining tirnash xususiyati paydo bo'lishi mumkin. Surunkali ta'sirga olib kelishi mumkin pnevmonit va boshqa belgilar sezgirlik nikelga, masalan, teri döküntüsü ("nikel qichishi").[26]
| NFPA 704 olov olmos | |
|---|---|
Nikel, shuningdek, mumkin bo'lgan inson sifatida baholanadi kanserogen tomonidan IARC (2B guruhi, Evropa Ittifoqining 3-toifasi ) va teratogen, jarima bilan nafas olish paytida alyuminiy oksidi zarralari bilan bog'liq Shaver kasalligi.
Rivojlanish
Myurrey Raney dan muhandis-mexanik mutaxassisligi bo'yicha bitirgan Kentukki universiteti 1909 yilda. 1915 yilda u Tennesi shtatidagi Lookout Oil and Refining Company-ga qo'shildi va o'rnatish uchun javobgardir elektrolitik hujayralar da ishlatilgan vodorod ishlab chiqarish uchun gidrogenlash o'simlik moylari. Shu vaqt ichida sanoat tomonidan tayyorlangan nikel katalizatoridan foydalanilgan nikel (II) oksidi. Yaxshi katalizatorlar ishlab chiqarilishi mumkinligiga ishonib, 1921 yil atrofida u Lookout Oil-da ishlayotganda mustaqil tadqiqotlar o'tkazishni boshladi. 1924 yilda 1: 1 nisbatdagi Ni /Si qotishma ishlab chiqarildi, u natriy gidroksid bilan ishlov berilgandan so'ng, paxta yog'ini gidrogenatsiyalashda ishlatiladigan eng yaxshi katalizatordan besh marta faolroq ekanligi aniqlandi. Ushbu kashfiyot uchun patent 1925 yil dekabrda chiqarilgan.[27]
Keyinchalik, Raney nikel-silikon katalizatori uchun ishlatiladigan protseduraga o'xshash 1: 1 Ni / Al qotishmasini ishlab chiqardi. Natijada paydo bo'lgan katalizator yanada faolroq ekanligini aniqladi va 1926 yilda patent olishga ariza berdi.[28] Bu zamonaviy Raney nikel katalizatorlari uchun keng tarqalgan qotishma tarkibi.[2] Boshqa keng tarqalgan qotishma tarkibiga 21:29 Ni / Al va 3: 7 Ni / Al kiradi. Ushbu katalizatorlarning faolligi va tayyorlash protokollari har xil.[2][29]
Raney nikelini ishlab chiqqandan so'ng, alyuminiy bilan boshqa qotishma tizimlari ko'rib chiqildi, ulardan eng e'tiborlisi mis, ruteniy va kobalt.[30] Keyingi tadqiqotlar shuni ko'rsatdiki, ikkilik qotishmaga ozgina miqdorda uchinchi metall qo'shilsa, katalizatorning faolligi oshadi. Ba'zi keng tarqalgan promouterlar sink, molibden va xrom. Tayyorgarlikning muqobil usuli enantioselektiv Raney nikeli sirt ustida ishlab chiqilgan adsorbsiya ning tartarik kislota.[31]
Shuningdek qarang
- Nikel aluminidi
- Urushibara nikeli
- Riekel nikel
- Nikel borid katalizatori
- Raney kobalt, shunga o'xshash kobalt / alyuminiy qotishma katalizatori, ba'zida ba'zi gidrogenlash mahsulotlari uchun ko'proq tanlanadi (masalan, birlamchi ominlar orqali nitrilning kamayishi ).[2]
Adabiyotlar
- ^ a b "Shimgich nikel". Evropa kosmik agentligi.
- ^ a b v d Nishimura, Shigeo (2001). Organik sintez uchun bir xil bo'lmagan katalitik gidrogenlash bo'yicha qo'llanma (1-nashr). Nyu York: Wiley-Intertersience. 7-19 betlar. ISBN 9780471396987.
- ^ a b Billika, Garri; Adkins, Gomer (1949). "Cataylst, Raney Nickel, W6 (tarkibida alyuminiy va adsorbsiyalangan vodorod miqdori yuqori)". Organik sintezlar. 29: 24. doi:10.15227 / orgsyn.029.0024.; Jamoa hajmi, 3, p. 176
- ^ Qarang:
- Rani, Myurrey, "Nozik bo'lingan nikel ishlab chiqarish usuli" AQSh patenti 1,628,190 (topshirilgan: 1926 yil 14-may; chiqarilgan: 1927 yil 10-may).
- M. S. Ueynrayt, "3.2 Skelet metall katalizatorlari" da: Gerhard Ertl, Helmut Knözinger va Jens Weitkamp, ed.s, Qattiq katalizatorlarni tayyorlash (Vaynxaym, Germaniya Federativ Respublikasi: Wiley-VCH Verlag, 1999), 28–29 betlar.
- ^ Yang, Teng-Kyuey; Li, Dong-Sheng; Xas, Yuliya (2005). "Raney Nikel". Organik sintez uchun reaktivlar entsiklopediyasi. Nyu York: John Wiley & Sons. doi:10.1002 / 047084289X.rr001.pub2.
- ^ "Mutaxassislik katalizatorlari va texnologiyalari". Grace kompaniyasi. Arxivlandi asl nusxasi 2009 yil 21 oktyabrda.
- ^ a b v d e f Ertl, Gerxard; Knözinger, Helmut (1997). Qattiq katalizatorlarni tayyorlash. Vili. 30-34 betlar. ISBN 3-527-29826-6.
- ^ a b Smit, A.J.; Trimm, D.L. (2005). "Skelet katalizatorlarini tayyorlash". Annu. Rev. Mater. Res. 35: 127. doi:10.1146 / annurev.matsci.35.102303.140758.
- ^ M. Guisnet, tahrir. (1993). Geterogen kataliz va mayda kimyoviy moddalar III: 3-xalqaro simpozium ishi. Elsevier. p. 69. ISBN 0-444-89063-7.
- ^ Krouford, Jerald (2003 yil aprel). "Ekzotik qotishma uyani topadi". Nikel jurnali. Olingan 19 dekabr 2006.
- ^ Carruthers, V (1986). Organik sintezning ba'zi zamonaviy usullari. Kembrij universiteti matbuoti. 413-414 betlar. ISBN 0-521-31117-9.
- ^ Hauptmann, Geynrix; Valter, Volfgang Ferdinand (1962). "Raney Nikelning organik oltingugurt aralashmalariga ta'siri". Kimyoviy. Rev. 62 (5): 347. doi:10.1021 / cr60219a001.
- ^ "Organik sintezda Raney nikelidan foydalanish". 2005. Arxivlangan asl nusxasi 2009 yil 5-iyunda. Olingan 1 avgust 2009.
- ^ a b v Solomons, TW. Grem; Frayl, Kreyg B. (2004). Organik kimyo. Vili. ISBN 0-471-41799-8.
- ^ Jonathan Klayden; Nik Grives; Styuart Uorren (2012). Organik kimyo (2 nashr). Oksford universiteti matbuoti. ISBN 9780199270293.
- ^ Grem, A. R .; Millidj, A. F.; Young, D. P. (1954). "Dizobutilenning oksidlanish mahsulotlari. III qism. 1,2-epoksi-2,4,4-trimetilpentanning halqa ochilishidan hosil bo'lgan mahsulotlar". Kimyoviy jamiyat jurnali (qayta tiklandi): 2180. doi:10.1039 / JR9540002180.
- ^ Gassman, P. G.; van Bergen, T. J. (1988). "Anilinlardan indollar: Etil 2-metilindol-5-karboksilat". Organik sintezlar. doi:10.15227 / orgsyn.056.0072.; Jamoa hajmi, 6, p. 601
- ^ Xebergberg, Xans Erik; Xedenstroem, Erik; Faegerag, Jonas; Servi, Stefano (1992). "Tiofenepropaenallarning novvoylar tomonidan xamirturush kamayishi. Enantiyoselektiv sintez (S) -2-metil-1-alkanollar novvoylarning xamirturush vositachiligi bilan 2-metil-3- (2-tiofen) propenallarni kamaytirishi ". J. Org. Kimyoviy. 57 (7): 2052–2059. doi:10.1021 / jo00033a028.
- ^ Sahifa, G. A .; Tarbell, D. S. (1963). "β- (o-Karboksifenil) propion kislotasi ". Organik sintezlar. 34: 8. doi:10.15227 / orgsyn.034.0008.; Jamoa hajmi, 4, p. 136
- ^ Robinson, X.K.; Snayder, H. R. (1955). "f-feniletilamin". Organik sintezlar. 23: 71. doi:10.15227 / orgsyn.023.0071.; Jamoa hajmi, 3, p. 720
- ^ Shvenk, E .; Papa, D .; Xankin, H.; Ginsberg, H. (1955). "b-n-Propilbutirolakton va b- (Tetrahidrofuril) propion kislotasi". Organik sintezlar. 27: 68. doi:10.15227 / orgsyn.027.0068.; Jamoa hajmi, 3, p. 742
- ^ Aleksakis, Aleks; Lensen, Natali; Mangeney, Per (1991). "Raney Nikel tomonidan gidrazinlarda N-N obligatsiyalarini ultratovush yordamida ajratish". Sintlet. 1991 (9): 625–626. doi:10.1055 / s-1991-20818.
- ^ Enders, D .; Pieter, R .; Renger, B .; Seebach, D. (1988). "Nukleofil a-sek-aminoalkillanish: 2- (difenilgidroksimetil) piroliden". Organik sintezlar. 58: 113. doi:10.15227 / orgsyn.058.0113.; Jamoa hajmi, 6, p. 542
- ^ Rays, R. G.; Kohn, E. J. (1963). "N,N '-Dietilbenziden ". Organik sintezlar. 36: 21. doi:10.15227 / orgsyn.036.0021.; Jamoa hajmi, 4, p. 283
- ^ Armor, M.-A (2003). Xavfli laboratoriya kimyoviy moddalarini yo'q qilish bo'yicha qo'llanma. CRC Press. p. 331. ISBN 1-56670-567-3.
- ^ "Nikel aluminidi MSDS" (PDF). Elektron kosmik mahsulotlar xalqaro. 1994 yil. Olingan 7 iyul 2009.[doimiy o'lik havola ]
- ^ AQSh 1563587, Murray Raney, "Katalitik materialni tayyorlash usuli", 1925-12-01 yillarda chiqarilgan (Reynining asl nikel-kremniy katalizatori)
- ^ AQSh 1628190, Murray Raney, "Nozik bo'lingan nikel ishlab chiqarish usuli", 1927-05-10 yillarda chiqarilgan
- ^ Urushibara, Yoshiyuki; Nishimura, Shigeo (1957). "Raney Nikel katalizatorini katta faollik bilan tayyorlash usuli". Buqa. Kimyoviy. Soc. Jpn. 30 (2): 199. doi:10.1246 / bcsj.30.199.
- ^ Augustine, Robert L. (1996). Sintetik kimyogar uchun heterojen kataliz. CRC Press. 248-249 betlar. ISBN 0-8247-9021-9.
- ^ Bakker, M. L .; Yosh, D. J .; Ueynrayt, M. S. (1988). "NiAlni tanlab yuvish3 va Ni2Al3 Raney nikellarini hosil qilish uchun intermetaliklar ". J. Mater. Ilmiy ish. 23 (11): 3921–3926. doi:10.1007 / BF01106814.
Tashqi havolalar
- Xalqaro kimyoviy xavfsizlik kartasi 0062
- Kimyoviy xavf-xatarlarga qarshi NIOSH cho'ntak qo'llanmasi
- 1941 yil W-2 markali Raney nikelini tayyorlashni tasvirlaydigan qog'oz: Mozingo, Ralf (1941). "Katalizator, Raney Nikel, W-2". Organik sintezlar. 21: 15. doi:10.15227 / orgsyn.021.0015.

