Ruteniy (IV) oksidi - Ruthenium(IV) oxide
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Ruteniy (IV) oksidi | |
| Boshqa ismlar Ruteniy dioksid | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ECHA ma'lumot kartasi | 100.031.660 |
| EC raqami |
|
PubChem CID | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| RuO2 | |
| Molyar massa | 133.0688 g / mol |
| Tashqi ko'rinish | ko'k-qora qattiq |
| Zichlik | 6,97 g / sm3 |
| Qaynatish nuqtasi | 1200 ° C (2,190 ° F; 1,470 K) sublimatsiya |
| erimaydigan | |
| +162.0·10−6 sm3/ mol | |
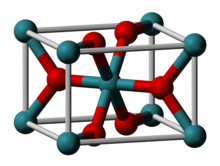
| Tuzilishi | |
| Rutil (to'rtburchak), tP6 | |
| P42/mnm, № 136 | |
| Oktahedral (RuIV); trigonal planar (O2−) | |
| Xavf | |
| Xavfsizlik ma'lumotlari varaqasi | Qarang: ma'lumotlar sahifasi |
| o't olish nuqtasi | Yonuvchan emas |
| Tegishli birikmalar | |
Boshqalar anionlar | Ruteniy disulfid |
Boshqalar kationlar | Osmiy (IV) oksidi |
| Ruteniy tetroksidi | |
| Qo'shimcha ma'lumotlar sahifasi | |
| Sinishi ko'rsatkichi (n), Dielektrik doimiy (εr), va boshqalar. | |
Termodinamik ma'lumotlar | Faza harakati qattiq-suyuq-gaz |
| UV nurlari, IQ, NMR, XONIM | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Ruteniy (IV) oksidi bo'ladi noorganik birikma formula bilan RuO2. Ushbu qora qattiq moddalar eng keng tarqalgan oksidi hisoblanadi ruteniy. U sifatida keng ishlatiladi elektrokatalizator xlor, xlor oksidlari va O ishlab chiqarish uchun2 katalizator - ruteniy (IV) oksidi.[1] Ko'p dioksidlar singari, RuO2 qabul qiladi rutil tuzilishi.[2][3]
Tayyorgarlik
Odatda oksidlanish orqali tayyorlanadi ruteniyum triklorid. RuO ning deyarli stexiometrik yagona kristallari2 tomonidan olinishi mumkin kimyoviy bug 'tashish, O dan foydalanib2 transport agenti sifatida:[4]
- RuO2 + O2 O RuO4
RuO filmlari2 tomonidan tayyorlanishi mumkin kimyoviy bug 'cho'kmasi (CVD) uchuvchan ruteniyum birikmalaridan.[5] RuO2 orqali ham tayyorlanishi mumkin elektrokaplama ruteniy triklorid eritmasidan.[6]
Rutenium tetroksidning suvli eritmasidagi avtokatalitik qisqarishidan foydalanib, toza ruteniy dioksid gidratining elektrostatik stabillashgan gidrosollari tayyorlandi. Olingan zarrachalar populyatsiyalari asosan monodisperslar, 40nm - 160nm diapazonli bir xil sharlarni o'z ichiga olishi uchun boshqarilishi mumkin.[7]
Foydalanadi
Ruteniy (IV) oksidi Sumitomo- katalizatorining asosiy komponenti sifatida ishlatiladiDikon jarayoni ishlab chiqaradi xlor oksidlanish bilan vodorod xlorid.[8][9]
RuO2 boshqa holatlarda katalizator sifatida ishlatilishi mumkin. E'tiborga loyiq reaktsiyalar - bu Fischer-Tropsch jarayoni, Haber-Bosch jarayoni, va turli xil ko'rinishlari yonilg'i xujayralari.
Potentsial va joyli dasturlar
RuO2 xlorni elektrolitik ishlab chiqarish uchun titan anotlarini qoplash va tayyorlash uchun keng qo'llaniladi rezistorlar yoki integral mikrosxemalar.[10][11] Ruteniy oksidi rezistorlari harorat oralig'ida sezgir termometr sifatida ishlatilishi mumkin .02
Adabiyotlar
- ^ Mills, A. "Kislorod va xlor evolyutsiyasi uchun bir xil bo'lmagan oksidlanish-qaytarilish katalizatorlari" Kimyoviy. Sot. Rev.,1989, 18, 285-316. doi:10.1039 / CS9891800285
- ^ Vaykoff, RWG .. Kristalli tuzilmalar, Jild 1. Intercience, John Wiley & Sons: 1963 yil.
- ^ Uells, A. F. (1975), Strukturaviy noorganik kimyo (4-nashr), Oksford: Clarendon Press
- ^ Xarald Schäfer, Gerd Schneidereit, Wilfried Gerhardt "Zur Chemie der Platinmetalle. RuO2 Chemischer Transport, Eigenschaften, termischer Zerfall" Z. anorg. allg. Kimyoviy. 1963, 319, 327-336. doi:10.1002 / zaac.19633190514
- ^ Pitszini, S .; Buzzancae, G.; Mat Res. Buqa., 1972, 7, 449-462.
- ^ Li, S. (2003). "Amorf ruteniy oksidi yupqa plyonkalarining elektrokromizmi". Qattiq holat ionlari. 165 (1–4): 217–221. doi:10.1016 / j.ssi.2003.08.035.
- ^ McMurray, H. N. (1993). "Ruteniy dioksid gidratining bir xil kolloidlari ruteniy tetroksidining sirt katalizli kamayishi bilan rivojlangan". Jismoniy kimyo jurnali. 97 (30): 8039–8045. doi:10.1021 / j100132a038.
- ^ Helmut Vogt, Jan Balj, Jon E. Bennet, Piter Vintzer, Said Akbar Shayx, Patrizio Gallone "Xlor oksidlari va xlor kislorod kislotalari" Ullmannning Sanoat Kimyosi Entsiklopediyasida 2002, Wiley-VCH. doi:10.1002 / 14356007.a06_483
- ^ Seki, K; Katal. Surv. Osiyo, 2010, 14, 168 doi:10.1007 / s10563-010-9091-7.
- ^ De Nora, O .; Kimyoviy. Ing. Texn., 1970, 42, 222.
- ^ Iles, G.S .; Platinum met. Rev., 1967,11,126.
- ^ Matthey, Jonson. Platinum metallarini ko'rib chiqish. 2002, 46, 3, 105
- ^ Kim, Il-Xvan; Kim, Kvan-Bum; Elektrokimyo. Solid State Lett., 2001, 4, 5, A62-A64
