Xlorid kislota - Chlorous acid
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Xlorid kislota | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| KEGG | |
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
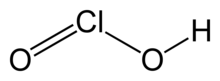
| HClO2 | |
| Molyar massa | 68,46 g / mol |
| Kislota (p.)Ka) | 1.96 |
| Birlashtiruvchi taglik | Xlorit |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Xlorid kislota bu noorganik birikma HClO formulasi bilan2. Bu kuchsiz kislota. Xlor bor oksidlanish darajasi Bu kislotada +3. Sof moddalar beqaror, nomutanosiblik ga gipoxlorli kislota (Cl oksidlanish darajasi +1) va xlorid kislota (Cl oksidlanish darajasi +5):
- 2 HClO2 → HClO + HClO3
Kislotani sof moddada olish qiyin bo'lsa ham, konjugat asos, xlorit, bu kislotadan olingan turg'undir. Ushbu anion tuzining bir misoli taniqli natriy xlorit. Bu va unga tegishli tuzlar ba'zan ishlab chiqarishda ishlatiladi xlor dioksid.
Tayyorgarlik
HClO2 bariy yoki qo'rg'oshin xlorit va suyultirish reaktsiyasi orqali tayyorlanishi mumkin sulfat kislota:
- Ba (ClO2)2 + H2SO4 → BaSO4 + 2 HClO2
- Pb (ClO2)2 + H2SO4 → PbSO4 + 2 HClO2
Barqarorlik
Xlorid kislota kuchli oksidlovchi moddadir, ammo uning nomutanosiblik tendentsiyasi uning oksidlanish potentsialiga qarshi turadi.
Xlor yagona halogen HXO formulasining ajraladigan kislotasini hosil qilish uchun2.[1] Ham brom kislotasi na yod kislotasi hech qachon izolyatsiya qilingan. Ning bir nechta tuzlari brom kislotasi, bromitlar ma'lum, ammo yo'q yoditlar.[1]
Adabiyotlar
![]() Bilan bog'liq ommaviy axborot vositalari Xlorid kislota Vikimedia Commons-da
Bilan bog'liq ommaviy axborot vositalari Xlorid kislota Vikimedia Commons-da
| Bu noorganik birikma - tegishli maqola a naycha. Siz Vikipediyaga yordam berishingiz mumkin uni kengaytirish. |
