Dikobalt oktakarbonil - Dicobalt octacarbonyl
 | |
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Oktakarbonildikobalt (Co-Co) | |
| Boshqa ismlar Kobalt karbonil, di-mu-Karbonilheksakarbonildikobalt, Kobalt oktakarbonil, Kobalt tetrakarbonil dimer, Dikobalt karbonil, Oktakarbonildikobalt | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.030.454 |
| EC raqami |
|
PubChem CID | |
| RTECS raqami |
|
| UNII | |
| BMT raqami | 3281 |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| Co2(CO)8 | |
| Molyar massa | 341,95 g / mol |
| Tashqi ko'rinish | qizil-to'q sariq rangli kristallar sof bo'lganda oq kristall qattiq[1] |
| Zichlik | 1,87 g / sm3 |
| Erish nuqtasi | 51 dan 52 ° C gacha (124 dan 126 ° F; 324 dan 325 K gacha) |
| Qaynatish nuqtasi | 52 ° C (126 ° F; 325 K) c.a. parchalanadi |
| erimaydigan | |
| Bug 'bosimi | 0,7 mm simob ustuni (20 ° C)[1] |
| Tuzilishi | |
| 1.33 D. (C2v izomer) 0 D. (D.3d izomer) | |
| Xavf | |
| Asosiy xavf | Juda zaharli, parchalanish jarayonida CO gazini rivojlantiradi,[1] piroforik, kanserogen |
| Xavfsizlik ma'lumotlari varaqasi | Tashqi MSDS |
| GHS piktogrammalari |     |
| GHS signal so'zi | Xavfli |
| H228, H251, H302, H312, H315, H317, H319, H330, H334, H350, H351, H361, H412 | |
| NFPA 704 (olov olmos) | |
| o't olish nuqtasi | Piroforik [1] |
| NIOSH (AQSh sog'lig'iga ta'sir qilish chegaralari): | |
PEL (Joiz) | yo'q[1] |
REL (Tavsiya etiladi) | TWA 0,1 mg / m3[1] |
IDLH (Darhol xavf) | N.D.[1] |
| Tegishli birikmalar | |
Tegishli metall karbonillari | Temir pentakarbonil Diiron nonakarbonil Tetrakarbonil nikel |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar berilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
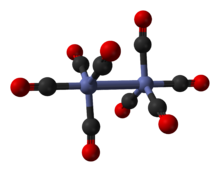
Dikobalt oktakarbonil bo'ladi organometalik birikma tarkibida Co2(CO)8. Bu metall karbonil sifatida ishlatiladi reaktiv va katalizator yilda organometalik kimyo va organik sintez, va ko'pchilik uchun markaziy hisoblanadi organokobalt kimyosi.[2][3] Bu a gidroformillanish katalizator, kobalt tetrakarbonil gidrid.[4] Har biri molekula ikkitadan iborat kobalt sakkizga bog'langan atomlar uglerod oksidi ligandlar garchi bir nechta aniq tarkibiy kelishuvlar ma'lum bo'lsa ham.[5] Karbonil ligandlarning bir qismi yuqori darajada labil. Murakkab yuqori reaktivdir alkinlar, va ba'zida alkin sifatida ishlatiladi himoya guruhi. Kobalt-alkin kompleksi sifatida u ikkalasini ham targ'ib qilishda muhim rol o'ynaydi Nikolay reaktsiyasi[3][6][7] va Pauson-Xand reaktsiyasi.[3][8][9]
Sintez, tuzilishi, xususiyatlari
Dikobalt oktakarbonil yuqori darajada toza bo'lgan oq tanadir, lekin odatda to'q sariq rangga ega, piroforik termal jihatdan beqaror bo'lgan qattiq.[1] U yuqori bosim bilan sintezlanadi karbonilatlanish kobalt (II) tuzlar. Jeyms Eli Knap tomonidan patentlangan usulda, kobalt (II) asetat 150 dan 200 ° C gacha isitiladi va ta'sir qiladi vodorod va uglerod oksidi 2000 dan 6000 gacha bosimdagi gazlarpsi:[10]
- 2 Co (CH3CO2)2 + 8 CO + 2 H2 → Co2(CO)8 + 4 CH3COOH
Tayyorgarlik ko'pincha mavjud bo'lganda amalga oshiriladi siyanid, kobalt (II) tuzini geksasiyanokobaltat (II) kompleksiga aylantiradi, keyinchalik u uglerod oksidi bilan ishlanib, K [Co (CO) hosil qiladi.4]. Kislota hosil qiladi kobalt tetrakarbonil gidrid, HCo (CO)4, keyinchalik uni isitib, dikobalt oktakarbonil hosil qilish mumkin.[3][11] Shuningdek, uni kobalt metallni 250 ° C dan yuqori oqimgacha qizdirib tayyorlash mumkin uglerod oksidi gaz taxminan 200 dan 300 gachaatm:[3]
- 2 Co + 8 CO → Co2(CO)8
Bir nechta mavjud ekanligi ma'lum izomerik shakllari, barchasi bir xil tarkibga ega - [Co2(CO)8] - ikkita kobalt metall markazlari bilan oksidlanish darajasi nol sakkiz karbonil (CO) bilan o'ralgan ligandlar. Ushbu ligandlar bo'lishi mumkin ko'prik ikkita kobalt markazlari orasidagi yoki bitta metall markazga bog'langan (a terminal ligand ).[2][3] Qarorda tez o'zaro almashinadigan ikkita izomer mavjud:[5]
Asosiy izomer (yuqoridagi chap tomonda muvozanat Jarayon) tarkibida kobalt markazlarini bog'laydigan ikkita ko'prikli karbonil ligand va oltita terminal karbonil ligand mavjud, ularning har biri uchta metallga.[5] U (CO) formulasi bilan umumlashtirilishi mumkin3Co (m-CO)2Co (CO)3 va C ga ega2v simmetriya. Ushbu tuzilishga o'xshaydi diiron nonakarbonil (Fe2(CO)9) lekin ko'piksiz karbonil bilan. Co-Co masofasi 2,52 Å, va Co-COTerminal va CO-COko'prik masofalar mos ravishda 1,80 va 1,90 are.[12] Bog'lanishni tahlil qilish to'g'ridan-to'g'ri kobalt-kobalt aloqasi yo'qligini ko'rsatadi.[13]
Kichik izomerda ko'prikli karbonil ligandlar yo'q, aksincha har bir metall atomida to'rttadan kobalt markazlari va sakkizta terminal karbonil ligandlar o'rtasida to'g'ridan-to'g'ri bog'lanish mavjud.[5] U (CO) formulasi bilan umumlashtirilishi mumkin4Co-Co (CO)4 va D bor4d simmetriya. Unda kristallashtirilganda qattiq tuzilish uzunligi 2,70 is bo'lgan cheksiz kobalt-kobalt aloqasi mavjud. C60.[14]
Reaksiyalar
Nikolay reaktsiyasi
The Nikolay reaktsiyasi a almashtirish reaktsiyasi shu bilan an-ning uglerodida joylashgan alkoksi guruhi alkin boshqasi bilan almashtiriladi nukleofil.[6][7] Alkin avval dikobalt oktakarbonil bilan reaksiyaga kirishadi, undan stabillashadigan hosil bo'ladi propargilik kation[15][16] kiruvchi nukleofil bilan reaksiyaga kirishadi va keyinchalik mahsulot hosil bo'ladi oksidlovchi demetallatsiya.[6][7]

Pauson-Xand reaktsiyasi
The Pauson-Xand reaktsiyasi,[8] unda an alkin, alken va uglerod oksidi siklizlanib, a hosil qiladi siklopentenon, Co tomonidan katalizlanishi mumkin2(CO)8,[3][9] ammo keyinchalik yanada samarali bo'lgan yangi usullar ishlab chiqilgan:[17][18]

Co2(CO)8 bilan reaksiyaga kirishadi alkinlar sifatida foydali bo'lgan barqaror kovalent kompleks hosil qilish himoya guruhi alkin uchun. Ushbu kompleksning o'zi Pauson-Xand reaktsiyasida ham ishlatilishi mumkin.[8]
Molekulyar Pauson-Xand reaktsiyalari mumkin, bu erda boshlang'ich tarkibida alken va alkin qismlari mavjud. In assimetrik sintez ning Likopodium alkaloid guperzin-Q, Takayama va uning hamkasblari an antikrotsikl qilish uchun molekula ichidagi Pauson-Xand reaktsiyasidan foydalanganlar sirka o'z ichiga olgan tert-butildifenilsilil (TBDPS) himoyalangan birlamchi spirt.[19] Dikobalt oktakarbonilni kiritilishidan oldin tsiklik siloksan qismini tayyorlash mahsulotning kerakli miqdorda hosil bo'lishini ta'minlaydi. konformatsiya.[20]


Qadam 1: Ajratish uglerod oksidi dan kobalt tetrakarbonil gidrid shakllantirmoq HCo (CO)3, faol katalitik turlar
Qadam 2: Kobalt markazi a hosil qiladi π obligatsiya alkenga
Qadam 3: Alkene ligand kobalt-gidrid bog'lanishiga qo'shiladi
Qadam 4: Qo'shimcha karbonil ligandni muvofiqlashtirish
Qadam 5: Ko'chib o'tishni kiritish karbonil ligandning kobalt-alkil bog'lanishiga aylanib, alkil tetrakarbonil oraliq moddasini asil trikarbonil turiga aylantiradi.[21]
Qadam 6: Oksidlanish ning dihidrogen dihidrido kompleksiga olib keladi
Qadam 7: Tomonidan chiqarilgan Aldegid mahsuloti reduktiv eliminatsiya,[22] faol katalitik turlarni qayta tiklash
Qadam 8: Samarasiz va qaytariladigan yon reaktsiya
Gidroformillanish
Gidrogenlash Co2(CO)8 kobalt tetrakarbonil gidrid ishlab chiqaradi, [HCo (CO)4]:[23]
- Co2(CO)8 + H2 → 2 HCo (CO)4
Ushbu gidrid a sifatida ishlatiladi katalizator uchun gidroformillanish - terminalni konvertatsiya qilish alken, RCH = CH2, ga aldegid, RCH2CH2CHO.[4][23] The katalitik tsikl Buning uchun gidroformillanish diagrammada ko'rsatilgan.[4][21][22]
CO ning kamayishi2(CO)8 bilan natriy amalgam beradi konjuge asos HCo (CO)4. Bu tuz gidridni kislotalashga olib keladi va shu turga muqobil sintetik yo'l beradi.[3] Ushbu shakldagi tuzlar, shuningdek, dikobalt oktakarbonil uchun siyanid sintez yo'lidagi oraliq moddalardir.[11]
- Co2(CO)8 + 2 Na → 2 NaCo (CO)4
- NaCo (CO)4 + H+ → HCo (CO)4 + Na+
CO ligandlarini uchinchi darajaga almashtirish mumkin fosfin Co berish uchun ligandlar2(CO)8−x(PR3)x. Ushbu yirik hosilalar gidroformillanish reaktsiyalari uchun ko'proq tanlangan katalizatorlardir.[3] "Qiyin "Lyuis bazalari, masalan. piridin, sabab nomutanosiblik:
- 12 S5H5N + 3 Co2(CO)8 → 2 [Co (C5H5N)6] [Co (CO)4]2 + 8 CO

Trikobalt nonakarbonillar
Isitish dekarbonilatsiyaga va hosil bo'lishiga olib keladi tetrakobalt dodekakarbonil:[3][24]
- 2 Co2(CO)8 → Co4(CO)12 + 4 CO
Ko'pgina metal karbonillari singari, dikobalt oktakarbonil ham alkilgalogenidlardan galidlarni ajraladi. Bilan reaksiyaga kirishganda bromoform, u aylanadi metilidinetrikobaltnonakarbonil, HCCo3(CO)9, quyidagicha idealizatsiya qilinishi mumkin bo'lgan reaktsiya bilan[25]
- 9 Co2(CO)8 + 4 CHBr3 → 4 HCCo3(CO)9 + 36 CO + 6 CoBr2
X-nurli kristallografik tahlil shuni ko'rsatadiki, mahsulot 2,48 near ga yaqin masofada kobalt atomlari uchburchagini o'z ichiga oladi, ularning har biri uchta terminal karbonil guruhiga bog'langan va metilidin (CH) uchburchak piramidaning tepasini tashkil etuvchi guruh. Ushbu mahsulot tarkibiy jihatdan tetrakobalt dodekakarbonil bilan bog'liq,[26] nazariy jihatdan metilidin guruhini to'rtinchi Co (CO) ga almashtirish orqali3 qism. Biroq, nazariya va tajriba o'rtasida tetrakobalt dodekakarbonilning uchta ko'prikli karbonil guruhiga ega ekanligi ko'rsatilgan haqiqiy tuzilishi bilan kelishmovchiliklar mavjud.[27][28][29]
Xavfsizlik
Co2(CO)8 kobaltning o'zgaruvchan manbai (0), bo'ladi piroforik va relizlar uglerod oksidi parchalanish paytida.[30] The Mehnatni muhofaza qilish milliy instituti bor tavsiya etiladi ishchilar 0,1 mg / m dan yuqori konsentrasiyalarga duch kelmasligi kerak3 O'rtacha sakkiz soatlik vaznda, to'g'ri nafas olish moslamasi bo'lmagan holda.[31]
Adabiyotlar
- ^ a b v d e f g h Kimyoviy xavf-xatarlarga qarshi NIOSH cho'ntagiga oid qo'llanma. "#0147". Mehnatni muhofaza qilish milliy instituti (NIOSH).
- ^ a b Pauson, Piter L.; Stambuli, Jeyms P.; Chou, Teh Chang; Hong, Bor-Cherng (2014). "Oktakarbonildikobalt". Organik sintez uchun reaktivlar entsiklopediyasi. John Wiley & Sons. doi:10.1002 / 047084289X.ro001.pub3.
- ^ a b v d e f g h men j Donaldson, Jon Dallas; Beyersmann, Detmar (2005). "Kobalt va kobalt aralashmalari". Ullmannning Sanoat kimyosi ensiklopediyasi. Vili-VCH. doi:10.1002 / 14356007.a07_281.pub2.
- ^ a b v d Elschenbroich, C .; Salzer, A. (1992). Organometallics: qisqacha kirish (2-nashr). Vaynxaym: Vili-VCH. ISBN 3-527-28165-7.
- ^ a b v d Svani, Rey L.; Jigarrang, Teodor L. (1977). "Matritsadan ajratilgan dikobalt oktakarbonilning infraqizil spektrlari. Uchinchi izomer uchun dalillar". Anorganik kimyo. 16 (2): 415–421. doi:10.1021 / ic50168a037.
- ^ a b v Nikolas, Kennet M. (1987). "Kobalt kompleksli propargil kationlarining kimyosi va sintetik foydasi". Acc. Kimyoviy. Res. (Sharh). 20 (6): 207–214. doi:10.1021 / ar00138a001.
- ^ a b v Teobald, Barri J. (2002). "Nikolay reaktsiyasi: sintezda dikobalt geksakarbonil bilan stabillashgan propargilik kationlarini ishlatish". Tetraedr (Sharh). 58 (21): 4133–4170. doi:10.1016 / S0040-4020 (02) 00315-0.
- ^ a b v Pauson, P. L.; Xand, I. U. (1977). "Organik sintezda kobalt-karbonil asetilen komplekslaridan foydalanish". Ann. N. Yad. Ilmiy ish. 295 (1): 2–14. doi:10.1111 / j.1749-6632.1977.tb41819.x.
- ^ a b Blanko-Urgoiti, Xayme; Anorbe, Loreto; Peres-Serrano, Letisiya; Domines, Gema; Peres-Kastells, Xaver (2004). "Pauson-Xand reaktsiyasi, murakkab molekulalarni sintez qilish uchun kuchli sintetik vosita". Kimyoviy. Soc. Rev. 33 (1): 32–42. doi:10.1039 / b300976a.
- ^ AQSh patenti 3236597, Knap, Jeyms Eli, "Yuqori darajadagi dikobalt oktakarbonil", 1966 yil 22 fevralda chiqarilgan, Union Carbide korporatsiyasi
- ^ a b Orchin, Milton (1953). "Organik birikmalarni sintez gazi bilan gidrogenlash". Katalizning yutuqlari. 5. Akademik matbuot. 385-415 betlar. ISBN 9780080565095.
- ^ Sumner, G. Gardner; Klug, Garold P.; Aleksandr, Leroy E. (1964). "Dikobalt oktakarbonilning kristalli tuzilishi". Acta Crystallographica. 17 (6): 732–742. doi:10.1107 / S0365110X64001803.
- ^ Yashil, Jennifer C.; Yashil, Malkolm L. H.; Parkin, Jerar (2012). "Kovalent noorganik birikmalarda uch markazli ikki elektronli bog'lanishlarning paydo bo'lishi va namoyishi". Kimyoviy aloqa. 2012 (94): 11481–11503. doi:10.1039 / c2cc35304k.
- ^ Garsiya, Thelma Y.; Fettinger, Jeyms S.; Olmstead, Merilin M.; Balch, Alan L. (2009). "Ajoyib simmetriya: Co ning cheksiz izomerining kristallanishi2(CO)8 Co da2(CO)8·C60". Kimyoviy aloqa. 2009 (46): 7143–7145. doi:10.1039 / b915083 soat.
- ^ Lokvud, Roza F.; Nikolas, Kennet M. (1977). "Sintetik qidiruv moddalar sifatida metall stabillashgan karbenium ionlarining o'tishi. I. a - [(alkinil) dikobalt geksakarbonil] karbenium ionlari propargilatlovchi moddalar sifatida". Tetraedr Lett. 18 (48): 4163–4165. doi:10.1016 / S0040-4039 (01) 83455-9.
- ^ Nikolas, K. M.; Pettit, R. (1972). "A- (alkinil) dikobalt geksakarbonil karboniy ionlarining barqarorligi to'g'risida". J. Organomet. Kimyoviy. 44 (1): C21-C24. doi:10.1016 / 0022-328X (72) 80037-8.
- ^ Shor, Nil E. (1991). "Tsiklopentenonlarni sintez qilish uchun Pauson-Khand siklok nashrining reaktsiyasi". Org. Javob bering. 40: 1. doi:10.1002 / 0471264180.or040.01.
- ^ Gibson, Syuzan E .; Stevenazzi, Andrea (2003). "Pauson-Xand reaktsiyasi: katalitik davr bu erda!". Angew. Kimyoviy. Int. Ed. 42 (16): 1800–1810. doi:10.1002 / anie.200200547.
- ^ Nakayama, Atsushi; Kogure, Noriyuki; Kitajima, Mariko; Takayama, Xiromitsu (2011). "Pentatsiklikning assimetrik total sintezi Likopodium Alkaloid: Guperzin ‐ Q ". Angew. Kimyoviy. Int. Ed. 50 (35): 8025–8028. doi:10.1002 / anie.201103550.
- ^ Xo, Tse-Lok (2016). "Dikobalt oktakarbonil". Organik sintez uchun Fiesers reaktivlari. 28. John Wiley & Sons. 251-252 betlar. ISBN 9781118942819.
- ^ a b Xek, Richard F.; Breslou, Devid S. (1961). "Kobalt gidrotetrakarbonilning Olefinlar bilan reaktsiyasi". Amerika Kimyo Jamiyati jurnali. 83 (19): 4023–4027. doi:10.1021 / ja01480a017.
- ^ a b Halpern, Jek (2001). "Yangi ming yillik ostonasida organometalik kimyo. Retrospektiv va istiqbol". Sof va amaliy kimyo. 73 (2): 209–220. doi:10.1351 / pac200173020209.
- ^ a b Pfeffer, M.; Grellier, M. (2007). "Kobalt Organometalik". Kengaytirilgan organometalik kimyo III. 7. Elsevier. 1–119 betlar. doi:10.1016 / B0-08-045047-4 / 00096-0.
- ^ Chini, P. (1968). "Yopiq metall karbonil klasterlari". Inorganica Chimica Acta sharhlari. 2: 31–51. doi:10.1016/0073-8085(68)80013-0.
- ^ Nestle, Mara O.; Hallgren, Jon E.; Seyfert, Dietmar; Douson, Piter; Robinson, Brayan H. (1980). "m3-Metilidin va m3-Benzilidin-Tris (Trikarbonilkobalt) ". Inorg. Sintez. 20: 226–229. doi:10.1002 / 9780470132517.ch53.
- ^ Leung, P .; Koppens, P .; MakMullan, R. K .; Koetzle, T. F. (1981). "Nonakarbonil-m ning tuzilishi3-metilidin-triangulo-trikobalt. Rentgen va neytron difraksiyasini o'rganish ". Acta Crystallogr. B. 37 (7): 1347–1352. doi:10.1107 / S0567740881005906.
- ^ Korradini, Paolo (1959). "Tetrakobaltdodekarbonilning tuzilishi". Kimyoviy fizika jurnali. 31 (6): 1676–1677. doi:10.1063/1.1730674.
- ^ Vey, Chin Xsuan (1969). "Tetrakobalt dodekakarbonil va tetrarhodium dodekakarbonilning strukturaviy tahlillari. Tartibsiz tuzilish va qo'shaloq kompozitsiyani kristalografik davolash". Anorganik kimyo. 8 (11): 2384–2397. doi:10.1021 / ic50081a030.
- ^ Farrugia, Lui J.; Braga, Dario; Grepioni, Fabriziya (1999). "Co tuzilishini qayta aniqlash4(CO)12: Dinamik buzilish va kristall fazada metall atomlari migratsiyasi yo'llari uchun dalillar ". Organometalik kimyo jurnali. 573 (1–2): 60–66. doi:10.1016 / S0022-328X (98) 00879-1.
- ^ Cole Parmer MSDS
- ^ CDC - NIOSH cho'ntak uchun kimyoviy xavf


