Uran dioksidi - Uranium dioxide
 | |
| Ismlar | |
|---|---|
| IUPAC nomlari Uran dioksidi Uran (IV) oksidi | |
| Boshqa ismlar Uraniya Uran oksidi | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.014.273 |
| EC raqami |
|
PubChem CID | |
| RTECS raqami |
|
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| UO2 | |
| Molyar massa | 270,03 g / mol |
| Tashqi ko'rinish | qora kukun |
| Zichlik | 10,97 g / sm3 |
| Erish nuqtasi | 2,865 ° C (5,189 ° F; 3,138 K) |
| erimaydigan | |
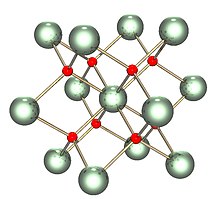
| Tuzilishi | |
| Florit (kub), cF12 | |
| Fm3m, № 225 | |
a = Soat 547,1 [1] | |
| Tetraedral (O2−); kub (UIV) | |
| Termokimyo | |
Std molar entropiya (S | 78 J · mol−1· K−1[2] |
Std entalpiyasi shakllanish (ΔfH⦵298) | -1084 kJ · mol−1[2] |
| Xavf | |
| Xavfsizlik ma'lumotlari varaqasi | ICSC 1251 |
| GHS piktogrammalari |    |
| GHS signal so'zi | Xavfli |
| H300, H330, H373, H400, H410, H411 | |
| P260, P264, P270, P271, P273, P284, P301 + 310, P304 + 340, P310, P314, P320, P321, P330, P391, P403 + 233, P405, P501 | |
| NFPA 704 (olov olmos) | |
| o't olish nuqtasi | Yo'q |
| Tegishli birikmalar | |
| Triuranium oktoksidi Uran trioksidi | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Uran dioksidi yoki uran (IV) oksidi (UO2), shuningdek, nomi bilan tanilgan uraniya yoki uran oksidi, bu oksid ning uran, va qora, radioaktiv, kristalli tabiiy ravishda mineralda uchraydigan kukun uraninit. Bu ishlatiladi yadro yoqilg'isi novda atom reaktorlari. Uran aralashmasi va plutonyum dioksid sifatida ishlatiladi MOX yoqilg'isi. 1960 yilgacha u sariq va qora rang sifatida ishlatilgan seramika sirlari va shisha.
Ishlab chiqarish
Uran dioksidi tomonidan ishlab chiqariladi kamaytirish uran trioksidi bilan vodorod.
- UO3 + H2 → UO2 + H2O 700 ° C (973 K) da
Ushbu reaktsiya yaratilishida muhim rol o'ynaydi yadro yoqilg'isi orqali yadroviy qayta ishlash va uranni boyitish.
Kimyo
Tuzilishi
Qattiq narsa izostrukturaviy bilan (bir xil tuzilishga ega) florit (kaltsiy ftoridi ), bu erda har bir U kub tartibda sakkizta eng yaqin qo'shnilar bilan o'ralgan. Bundan tashqari, ning dioksidlari seriy, torium, plutonyum va neptuniy bir xil tuzilmalarga ega. Boshqa hech qanday elementar dioksidlar florit tuzilishiga ega emas. Erish paytida U-O ning o'rtacha o'lchangan koordinatsiyasi kristalli qattiq moddada (UO) 8 dan kamayadi8 kublar), eritmada 6,7 ± 0,5 (3270 K da) gacha.[3] Ushbu o'lchovlarga mos modellar eritmaning asosan UO dan iborat ekanligini ko'rsatadi6 va UO7 ko'pburchak birliklar, bu erda taxminan2⁄3 ko'pburchak orasidagi bog'lanish burchak almashish va1⁄3 chekka almashish.[3]

Uran dioksidi

Sinerlangan uran dioksid pelleti
Oksidlanish
Uran dioksidi oksidlangan bilan aloqada kislorod uchun uchburchak oktaoksid.
- 3 UO2 + O2 → U3O8 700 ° C (970 K) da
The elektrokimyo sifatida uran dioksidning batafsil o'rganildi galvanik korroziya uran dioksidi ishlatilish tezligini boshqaradi yadro yoqilg'isi eriydi. Qarang ishlatilgan yadro yoqilg'isi batafsil ma'lumot uchun. Suv ning oksidlanish tezligini oshiradi plutonyum va uran metallar.[4][5]
Karbonizatsiya
Uran dioksidi karbonlangan bilan aloqada uglerod, shakllantirish uran karbid va uglerod oksidi.
UO2 + 4 C → UC2 + 2 CO
Ushbu jarayon an ostida bajarilishi kerak inert gaz kabi uran karbid osonlik bilan yana oksidlanadi uran oksidi.
Foydalanadi
Yadro yoqilg'isi
UO2 asosan sifatida ishlatiladi yadro yoqilg'isi, xususan UO sifatida2 yoki UO aralashmasi sifatida2 va PuO2 (plutonyum dioksid ) aralash oksid (MOX yoqilg'isi ) shaklida yonilg'i tayoqchalari yilda atom reaktorlari.
E'tibor bering issiqlik o'tkazuvchanligi uran dioksidi bilan taqqoslaganda juda past uran, uran nitridi, uran karbid va zirkonyum qoplama materiali. Ushbu past issiqlik o'tkazuvchanligi yonilg'i pelletlari markazlarida lokalizatsiya qilingan qizib ketishiga olib kelishi mumkin. Quyidagi grafikda har xil yoqilg'i birikmalaridagi har xil harorat gradyanlari ko'rsatilgan. Ushbu yoqilg'ilar uchun issiqlik quvvati zichligi bir xil va barcha granulalarning diametri bir xil.[iqtibos kerak ]

Uran oksidi yonilg'i pelleti

Rossiyadagi zavodda uran dioksidi yoqilg'isi pelletini ishlab chiqarish uchun materiallar konteynerlarini ishga tushirish

Zirkonyum metall va uran dioksidning issiqlik o'tkazuvchanligi haroratga bog'liq
Shisha keramik sir uchun rang
Uran oksidi (uraniya) Ikkinchi Jahon Urushidan oldin shisha va keramika rang berish uchun ishlatilgan va radioaktivlik qo'llanilmaguncha bu uning asosiy ishlatilishi bo'lgan. 1958 yilda AQShda ham, Evropada ham harbiylar uni uran sifatida tijorat maqsadlarida foydalanishga yana ruxsat berishdi va ulardan foydalanish yana cheklangan miqyosda boshlandi. Uraniya asosidagi keramika sirlari kamaytirilganda yoki UO yoqilganda quyuq yashil yoki qora rangga ega2 ishlatilgan; tez-tez u yorqin sariq, to'q sariq va qizil sirlarni olish uchun oksidlanishda ishlatiladi.[6] To'q rang Fiestaware uraniya rangidagi sirli mahsulotning taniqli namunasidir. Uran shishasi och yashildan sariq ranggacha va ko'pincha kuchli lyuminestsent xususiyatlarga ega. Uraniya formulalarida ham ishlatilgan emal va chinni. Bilan aniqlash mumkin Geyger hisoblagichi agar 1958 yilgacha ishlab chiqarilgan sir yoki oynada uraniya bo'lsa.
Boshqa foydalanish
Radiatsiya zararli ekanligini anglashdan oldin uran soxta tishlarga va protezlarga kiritilgan edi, chunki uning ozgina lyuminestsentsiyasi tufayli protezlar turli yoritish sharoitida haqiqiy tishlarga o'xshab ko'rinardi.
Tugadi UO2 (DUO2) uchun material sifatida ishlatilishi mumkin radiatsiyadan himoya qilish. Masalan, DUCRETE "og'ir beton "material qaerda shag'al uran dioksidi agregati bilan almashtiriladi; ushbu material foydalanish uchun tekshiriladi qutilar uchun radioaktiv chiqindilar. Kassalar DUO dan ham tayyorlanishi mumkin2-po'lat sermet, a kompozit material yasalgan yig'ma radiatsiyaviy himoya qiluvchi uran dioksid, grafit va / yoki kremniy karbid sifatida xizmat qilish neytron nurlanishi absorber va moderator va matritsa sifatida po'latdir, uning yuqori issiqlik o'tkazuvchanligi parchalanadigan issiqlikni oson olib tashlashga imkon beradi.[iqtibos kerak ]
Tugatilgan uran dioksidi a sifatida ham ishlatilishi mumkin katalizator, masalan. degradatsiyasi uchun uchuvchi organik birikmalar gazsimon fazada, oksidlanish ning metan ga metanol va olib tashlash oltingugurt dan neft. Tijorat reklamalar bilan taqqoslaganda VOClarni yo'q qilish uchun foydalanilganda yuqori samaradorlik va uzoq muddatli barqarorlikka ega katalizatorlar, kabi qimmatbaho metallar, TiO2 va Co3O4 katalizatorlar. Bu sohada juda ko'p tadqiqotlar olib borilmoqda, DU radioaktivligi pastligi sababli uran komponentiga ma'qul.[7]
Uran dioksididan material sifatida foydalanish qayta zaryadlanuvchi batareyalar tergov qilinmoqda. Batareyalar yuqori bo'lishi mumkin quvvat zichligi va potentsial hujayra uchun 4,7 V. Boshqa tekshirilgan ariza fotoelektrokimyoviy hujayralar UO bo'lgan quyosh yordamida vodorod ishlab chiqarish uchun2 sifatida ishlatiladi fotoanod. Avvalgi davrlarda uran dioksidi ham oqimni cheklash uchun issiqlik o'tkazuvchisi sifatida ishlatilgan (URDOX-rezistor), bu uning yarimo'tkazgich xususiyatlaridan birinchi foydalanish edi.[iqtibos kerak ]
Uran dioksidi, shuningdek, 30 dan past kriyogen haroratda kuzatilgan antiferromagnit holatdagi eng kuchli piezomagnitdir kelvinlar. UO2 qo'llaniladigan magnit maydon belgisi bilan belgini o'zgartiradigan chiziqli magnetostriktsiyani va magnitelastik xotirani 180.000 Oe yaqinidagi magnit maydonlarda almashtirishni ko'rsatadi.[8]
Yarimo'tkazgich xususiyatlari
The tarmoqli oralig'i uran dioksidi bilan solishtirish mumkin kremniy va galyum arsenidi, Quyosh radiatsiyasini yutish uchun tarmoqli oralig'i egri chizig'i va samaradorligi uchun eng maqbul darajaga yaqin, bu juda samarali foydalanish uchun uni ishlatishni taklif qiladi quyosh xujayralari asoslangan Shotti diodi tuzilish; u infraqizilni ham o'z ichiga olgan besh xil to'lqin uzunliklarida so'riladi va uning samaradorligini yanada oshiradi. Uning xona haroratidagi ichki o'tkazuvchanligi taxminan xuddi shunday bitta kristall kremniy.[9]
The dielektrik doimiyligi Uran dioksidi taxminan 22 ga teng, bu kremniy (11.2) va GaAs (14.1) ga qaraganda deyarli ikki baravar yuqori. Bu qurilishida Si va GaAlardan ustunlik integral mikrosxemalar, chunki u yuqori zichlik bilan yuqori zichlikka qo'shilishga imkon beradi buzilish kuchlanishi ga nisbatan past sezuvchanlik bilan CMOS tunnel sindirish.
The Seebeck koeffitsienti xona haroratida uran dioksidining qiymati 750 µV / K ni tashkil etadi, bu qiymat 270 µV / K ga nisbatan ancha yuqori talliy kalay tellurid (Tl.)2SnTe5) va talliy germanium telluridi (Tl.)2GeTe5) va of vismut -tellur qotishmalar, istiqbolli boshqa materiallar termoelektrik energiya ishlab chiqarish ilovalar va Peltier elementlari.
The radioaktiv parchalanish ta'siri 235U va 238Yarimo'tkazgich xususiyati bo'yicha U 2005 yilgacha o'lchanmagan[yangilash]. Ushbu izotoplarning sekin parchalanish tezligi tufayli u uran dioksidli quyosh xujayralari va termoelektr qurilmalarining xususiyatlariga ta'sir ko'rsatmasligi kerak, ammo bu muhim omil bo'lishi mumkin VLSI chiplar. Dan foydalanish tugagan uran oksid shu sababli kerak. Radioaktiv parchalanish paytida chiqadigan alfa zarralarini kristal panjarasidagi geliy atomlari sifatida tutilishi ham uning xususiyatlarida asta-sekin uzoq muddatli o'zgarishlarni keltirib chiqarishi mumkin.[iqtibos kerak ]
The stexiometriya materialning elektr xususiyatlariga keskin ta'sir qiladi. Masalan, UO ning elektr o'tkazuvchanligi1.994 UO ning o'tkazuvchanligidan yuqori haroratlarda kattaroq buyruqlardir2.001.
U kabi dioksid, U3O8, a seramika yuqori haroratga bardosh bera oladigan material (taxminan 2300 ° C, kremniy yoki GaA uchun maksimal 200 ° C ga nisbatan), bu uni termofotovoltaik qurilmalar kabi yuqori haroratli dasturlarga moslashtiradi.
Uran dioksidi ham chidamli nurlanish zarar etkazish, uni foydali qilish qattiq maxsus harbiy qurilmalar va aerokosmik ilovalar.
A Shotti diodi ning U3O8 va a p-n-p tranzistor UO2 laboratoriyada muvaffaqiyatli ishlab chiqarilgan.[10]
Toksiklik
Uran dioksidi so'rilishi ma'lum fagotsitoz o'pkada.[11]
Shuningdek qarang
Adabiyotlar
- ^ Linders, Gregori; Kardinallar, Tomas; Binnemans, Koen; Verwerft, Mark (2015). "Stoxiometrik uran dioksidining panjara parametrlarini aniq o'lchovlari". Yadro materiallari jurnali. 459: 135–42. Bibcode:2015JNuM..459..135L. doi:10.1016 / j.jnucmat.2015.01.029.
- ^ a b Zumdahl, Stiven S. (2009). Kimyoviy printsiplar 6-chi Ed. Houghton Mifflin kompaniyasi. p. A23. ISBN 978-0-618-94690-7.
- ^ a b Skinner, L. B .; Benmore, C. J .; Weber, J. K. R.; Uilyamson, M. A .; Tamalonis, A .; Xebden, A .; Wiensek, T .; Alderman, O. L. G.; Gutri, M.; Leybovits, L .; Parise, J. B. (2014). "Eritilgan uran dioksid tuzilishi va dinamikasi". Ilm-fan. 346 (6212): 984–7. Bibcode:2014Sci ... 346..984S. doi:10.1126 / science.1259709. OSTI 1174101. PMID 25414311.
- ^ Xashke, Jon M; Allen, Tomas H; Morales, Luis A (1999). "Plutonyum dioksidning suv va kislorod-vodorod aralashmalari bilan reaktsiyalari: uran va plutoniyning korroziya mexanizmlari" (PDF). Olingan 2009-06-06.
- ^ Xashke, Jon M; Allen, Tomas H; Morales, Luis A (2001). "Plutonyum dioksidning suv va vodorod-kislorod aralashmalari bilan reaktsiyalari: uran va plutonyum korroziyasi mexanizmlari". Qotishmalar va aralashmalar jurnali. 314 (1–2): 78–91. doi:10.1016 / S0925-8388 (00) 01222-6.
- ^ O'rtel, Stefan. Uran in Keramik. Geschichte - Technik - Hersteller.
- ^ Xetchings, Grem J.; Xenegan, Ketrin S.; Xadson, Yan D. Teylor, Styuart H. (1996). "Uchuvchi xlor-organik birikmalarni yo'q qilish uchun uran-oksidga asoslangan katalizatorlar". Tabiat. 384 (6607): 341–3. Bibcode:1996 yil Natur.384..341H. doi:10.1038 / 384341a0.
- ^ M. Xayme va boshq. (2017), Piezomagnetizm va uran dioksididagi magnetoelastik xotira. Tabiat aloqalari 8, 99.
- ^ An, Yong Q.; Teylor, Antuanetta J.; Konradson, Stiven D.; Trugman, Styuart A.; Durakievicz, Tomasz; Rodriguez, Jorj (2011). "Ultrafast Hopping Dynamics 5f Mott izolyatoridagi elektronlar2 Femtosaniyadagi nasos-proba spektroskopiyasi bo'yicha o'rganilgan ". Jismoniy tekshiruv xatlari. 106 (20): 207402. Bibcode:2011PhRvL.106t7402A. doi:10.1103 / PhysRevLett.106.207402. PMID 21668262.
- ^ Yumshoq, Tomas T.; fon Roedern, B. (2008). "Aktinid oksidlaridan tayyorlangan yarimo'tkazgichli qurilmalar". Vakuum. 83 (1): 226–8. Bibcode:2008 yil Vacuu..83..226M. doi:10.1016 / j.vacuum.2008.04.005.
- ^ Biokimyoviy toksikologiya asoslari. Timbrell, Jon. PA 2008 yil ISBN 0-8493-7302-6[sahifa kerak ]
Qo'shimcha o'qish
- Barret, S. A .; Jeykobson, A. J .; Tofild, B. S .; Fender, B. E. F. (1982). "Bariy uran oksidi BaUO3 + x ning tayyorlanishi va tuzilishi". Acta Crystallographica bo'limi B. 38 (11): 2775. doi:10.1107 / S0567740882009935.
Tashqi havolalar
- Uran oksidlarining yarim o'tkazgich xususiyatlari
- Uran dioksid uchun bepul lug'at ro'yxati
- The Uran dioksidi Xalqaro bio-analitik sanoat, Inc.







